
【题目】设在容积可变的密闭容器中充入10 mol N2(g)和10 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。计算[(1)、(2)的计算都需按格式写计算过程,否则答案对也不给分]
(1)该条件下反应N2(g)+3H2(g)![]() 2NH3(g) 的平衡常数________。(设该条件下,每1mol气体所占的体积为VL)
2NH3(g) 的平衡常数________。(设该条件下,每1mol气体所占的体积为VL)
(2)上述反应的平衡时,再充入10 mol的N2,根据计算,平衡应向什么方向移动________
(3)某温度下将所得的氨气配成0.1 molL-1的溶液,所得溶液的pOH_____;将该溶液冲稀100倍;计算此时氨水的电离度为________(已知该温度下Kb(NH3·H2O) =1.0×10-5)
【答案】 8v2(mol·L-1)-2 平衡向逆反应方向移动 3 10%
【解析】试题分析:(1)首先,利用“三段式”计算平衡时N2、 H2、NH3的物质的量,再根据![]() 计算平衡常数;(2)先计算再充入10 mol的N2时的浓度熵Q,再根据Q、K的比较判断平衡移动方向;(3)根据Kb(NH3·H2O) =1.0×10-5,计算0.1 molL-1的溶液中c(OH-),再利用pOH=
计算平衡常数;(2)先计算再充入10 mol的N2时的浓度熵Q,再根据Q、K的比较判断平衡移动方向;(3)根据Kb(NH3·H2O) =1.0×10-5,计算0.1 molL-1的溶液中c(OH-),再利用pOH=![]() 计算;将该溶液冲稀100倍,则浓度变为10-3 molL-1,根据Kb(NH3·H2O) =1.0×10-5,计算c(NH4+);再根据c(NH4+)÷c(NH3·H2O)计算电离度;
计算;将该溶液冲稀100倍,则浓度变为10-3 molL-1,根据Kb(NH3·H2O) =1.0×10-5,计算c(NH4+);再根据c(NH4+)÷c(NH3·H2O)计算电离度;
解析:(1)设达到平衡时,消耗氮气的物质的量是xmol;

![]()
X=2mol
平衡时N2、 H2、NH3的物质的量分别是8mol、4mol、4mol,每1mol气体所占的体积为VL,所以容器的体积是16vL,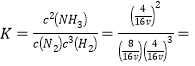 8v2(mol·L-1)-2。
8v2(mol·L-1)-2。
(2)上述反应的平衡时,再充入10 mol的N2,则N2、 H2、NH3的物质的量分别是18mol、4mol、4mol,每1mol气体所占的体积为VL,所以容器的体积是26vL,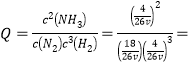 9.4v2(mol·L-1)-2>K,所以平衡向逆反应方向移动;(3) Kb(NH3·H2O)=
9.4v2(mol·L-1)-2>K,所以平衡向逆反应方向移动;(3) Kb(NH3·H2O)=![]() ,所以c(OH-)=10-3,pOH=
,所以c(OH-)=10-3,pOH=![]() =
=![]() =3;将该溶液冲稀100倍,则浓度变为10-3 molL-1,Kb(NH3·H2O)=
=3;将该溶液冲稀100倍,则浓度变为10-3 molL-1,Kb(NH3·H2O)=![]() ,c(NH4+)=10-4,电离度= c(NH4+)÷c(NH3·H2O)= 10-4÷10-3×100%=10%。
,c(NH4+)=10-4,电离度= c(NH4+)÷c(NH3·H2O)= 10-4÷10-3×100%=10%。


科目:高中化学 来源: 题型:
【题目】I.某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1 Na2S2O3溶液润洗,然后装入0.01mol·L-1 Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6。试回答下列问答:
(1)步骤①加入的指示剂是_______________________________。
(2)步骤②应使用________式滴定管。
(3)判断达到滴定终点的实验现象是___________________________________。
Ⅱ.(4)若用0.1032 mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是____________。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4 K1=5.9×10-2,K2=6.4×10-5。0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电导法测定某浓度醋酸电离的ΔH、Ka随温度变化曲线关系如图。已知整个电离过程包括氢键断裂、醋酸分子解离、离子水合。下列有关说法不正确的是
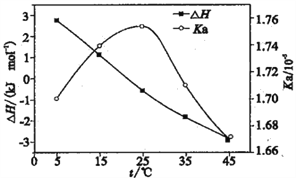
A. 理论上ΔH=0时,Ka最大
B. 25℃时,[CH3COOH]最大
C. 电离的热效应较小是因为分子解离吸收的能量与离子水合放出的能量相当
D. CH3COOH溶液中存在氢键是ΔH随温度升高而减小的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,稀释0.5mol·L-1的醋酸溶液,下图中的纵坐标不能表示
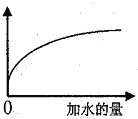
A. CH3COOH的电离程度 B. 溶液中H+的数目
C. 溶液中OH-的浓度 D. 溶液中CH3COOH的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿波罗宇宙飞船以N2H4(联氨)和N2O4为动力源,反应温度达27000C,反应化学方程式为2N2H4+N2O4=3N2+4H2O,下列关于该反应的叙述正确的是
A.属于置换反应
B.属于非氧化还原反应
C.N2H4是还原剂
D.N2是氧化产物,不是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式中不正确的是
A. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH—=SiO32—+H2O
B. 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I—+H2O2=I2+2H2O
C. 燃煤时加入适量石灰石粉末,可减少SO2的排放:2CaCO3+2SO2+O2![]() 2CaSO4+2CO2
2CaSO4+2CO2
D. 强碱溶液中,用次氯酸钠与Fe(OH)2反应制备高铁酸钠:2ClO—+ Fe(OH)2=FeO42—+2Cl—+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将 Cl2 通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向 Fe2(SO4)3 溶液中加入过量铁粉: Fe3++Fe=2Fe2+
C. 将 SO2 通入双氧水中: SO2+H2O2=2H++SO42-
D. 向 Na2SiO3 溶液中滴加稀盐酸: Na2SiO3+2H+=H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
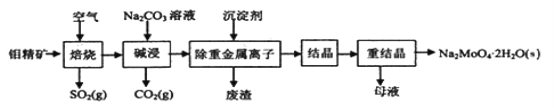
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为_____________,氧化产物是________(写化学式)。每转化生成1molMoO3时,需要转移的电子数是 _________。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com