
A��CH3OH��l��+
| ||
| B��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��l����H=-1452kJ?mol-1 | ||
C��CH3OH��l��+
| ||
D��CH3OH��l��+
|

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������H��0ʱ����ʾ�÷�ӦΪ���ȷ�Ӧ |
| B����Ҫ���Ȳ��ܽ��еķ�Ӧ�����ȷ�Ӧ |
| C����Ӧ�ȵĴ�С�뷴Ӧ�������е������������������е������� |
| D��1molNaOH�ֱ��1molCH3COOH��1molHNO3��Ӧ�ų���������CH3COOH��HNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
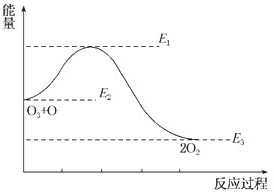
| A����ӦO3+O�T2O2�ġ�H=E1-E2 |
| B����ӦO3+O�T2O2�ġ�H=E2-E3 |
| C����ӦO3+O�T2O2�����ȷ�Ӧ |
| D����ӦO3+O�T2O2�ġ�H=��H1+��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��CO��g��+
| ||
| B��2CO��g��+O2��g��=2CO2��g������H=-565.9kJ/mol | ||
C��CO��g��+
| ||
D��CO��g��+
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ܱ������У�9.6g�����11.2g���ۻ�ϼ�������������17.6gʱ���ų�19.12kJ��������Fe��s��+S��s���TFeS��s����H=-95.6kJ��mol-1 |
| B��ϡ������0.1mol?L-1NaOH��Һ��Ӧ��H+��aq��+OH-��aq���TH2O��l����H=57.3kJ?mol-1 |
| C����֪1mol������ȫȼ������Һ̬ˮ���ų�������Ϊ285.5kJ����ˮ�ֽ���Ȼ�ѧ����ʽ��2H2O��l���T2H2��g��+O2��g����H=+285.5kJ��mol-1 |
| D����֪2C��s��+O2��g���T2CO��g����H=-22.1kJ��mol-1���֪C��ȼ���ȡ�H=-110.5kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| ��ѧʽ | CO��g�� | H2��g�� | CH3OH��l�� |
| ��H/��kJ?mol-1�� | -283.0 | -285.8 | -726.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2N2O5(g)��4NO2(g)��O2(g)����H��0 |
| B��2CO(g)=2C(s)+O2(g)����H��0 |
| C��(NH4)2CO3(s)��NH4HCO3(s)��NH3(g)����H��0 |
| D��2H2(g)��O2(g)��2H2O(l)����H��0 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com