
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 18 |
| 1 |
| 18 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、KCl |
| B、KCl和KBr |
| C、KCl和KI |
| D、KCl、Br2和I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、5:1 | D、11:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
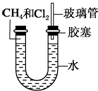 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:
 金属在人类文明的发展进程中发挥了巨大作用,在人们已知的100多种元素中,金属元素约占80%,以下是关于金属的一些问题,请回答:
金属在人类文明的发展进程中发挥了巨大作用,在人们已知的100多种元素中,金属元素约占80%,以下是关于金属的一些问题,请回答:| 金属 | K | Cu |
| 原子半径/pm | 255 | 128 |
| 熔点/℃ | mp1 | mp2 |
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 140℃ |
| 浓硫酸 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 颜色、状态 | 无色液体 | 无色液体 | 无色液体 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉和纤维素的化学式都是(C6H10O5)n,但由于n不同,淀粉和纤维素并不互为同分异构体 |
| B、鉴别某白色纺织品的成分是蚕丝还是“人造丝”,可用灼烧的方法 |
| C、乙醇可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液直接氧化成乙酸 |
| D、醇CH3CHOHCH3不能在铜或银作催化剂的条件下发生催化氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com