
【题目】室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )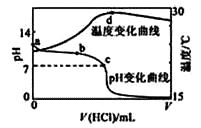
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c(NH3·H2O) > c(Cl-)
C.c点:反应消耗的HCl 和NH3·H2O 的关系为:n(HCl)= n(NH3·H2O)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
【答案】B
【解析】A、因a点7<pH<14,因此水电离出的c(H+)>1.0×10-14molL-1 , A不符合题意;
B、b点时pH>7,则盐酸和氨水反应,氨水过量,则c(NH4+)+c(NH3H2O)>c(Cl-),B符合题意;
C、氯化铵水溶液显酸性,c点pH=7溶液呈中性,故n(HCl)<n(NH3·H2O) ,C不符合题意;
D、d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,D不符合题意;
所以答案是:B
【考点精析】认真审题,首先需要了解酸碱中和滴定(中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点).


科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4 7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH 为3.0,沉淀完全时的pH为5.5:
回答下列问题:
(1)操作Ⅱ中用硫酸酸化至pH=2且通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②;
(2)操作IV的顺序依次为:、、过滤、洗涤。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②。
(4)测定绿矾产品中Fe2+ 含量的方法是:a.称取8.680g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.02000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为30.00 mL(滴定时发生反应的离子方程式为:5Fe2+ + MnO4- + 8H+ ═ 5Fe3+ + Mn2+ + 4H2O)
①计算上述样品中FeSO4 7H2O的质量分数为(结果保留4位有效数字,FeSO4 7H2O的摩尔质量为278g/mol)
②若用上述方法测定的样品中FeSO47H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有:样品中存在少量的杂质、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用托盘天平称量镁粉25.3g(1g以下用游码),他把镁粉放在右盘,当天平平衡时,所称取的镁粉的实际质量是( )
A.25.2gB.24.8gC.24.7gD.25.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家合成了一种新型除草剂的合成路线如下:
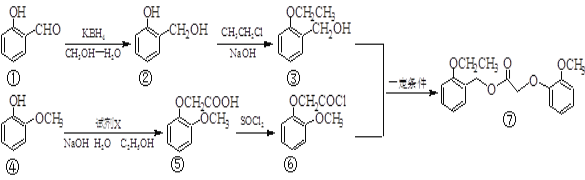
(1)① 中两种含氧官能团的名称_______、_____。除草剂⑦的分子式为_______ 。
(2)③与⑥生成⑦的反应类型是____,④⑤转化中另外一种产物是HCl,则试剂X是_____ 。
(3)写出一种同时满足下列条件的物质③的同分异构体的结构简式______________。
① 属于芳香族化合物; ② 苯环上的一取代物只有两种;
③ 在铜催化下与O2反应,其生成物1 mol与足量的银氨溶液反应生成4 mol Ag
(4)写出②③的化学方程式__________________________________________。
(5)卡巴拉丁是老年人认知障碍的重要治疗药物。请结合上述合成路线及下面所给的反应:![]()
ROH+SOCl2RCl+HOSOCl
请写出合成卡巴拉丁流程中A、B、D的结构简式,C试剂的化学式。
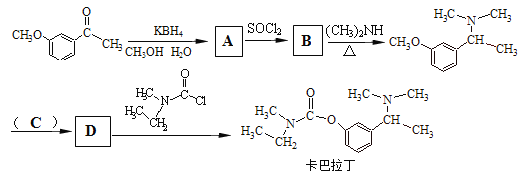
A:____________、B:_____________、C:____________、D:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水中加入等物质的量的Ag+、Pb2+、Na+、SO42﹣、NO3﹣、Cl﹣ , 该溶液放在用惰性材料做电极的电解槽中,通电片刻后,则氧化产物与还原产物的质量之比为( )
A.35.5:108
B.16:207
C.8:1
D.108:35.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO2的新工艺.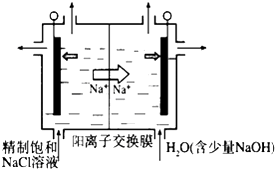
(1)①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: .
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol;用平衡移动原理解释阴极区pH增大的原因。
(2)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为;处理100m3这种污水,至少需要ClO2mol.
(3)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素③的原子结构示意图______;元素⑨形成的氢化物的电子式___________。
(3)表中元素④、⑨形成的氢化物的稳定性顺序为_____> (填化学式)。
(4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____> (填化学式)。
(5)表中元素③、④、⑥、⑦的原子半径大小为____> > > (填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com