
����Ŀ�������ڹ�ũҵ������������Ҫ���ã���ش����и��й����⡣
(1)�ð�����ȡ����[CO(NH2)2]�ķ�ӦΪ��2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(g) ��H��0.ij�¶��£����ݻ�Ϊ100L���ܱ�������ͨ��4mol NH3��2molCO2���÷�Ӧ���е�40sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%����ͼ�е����߱�ʾ�÷�Ӧ��ǰ25 s��NH3Ũ����ʱ��ı仯���仯��
CO(NH2)2(l)+H2O(g) ��H��0.ij�¶��£����ݻ�Ϊ100L���ܱ�������ͨ��4mol NH3��2molCO2���÷�Ӧ���е�40sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%����ͼ�е����߱�ʾ�÷�Ӧ��ǰ25 s��NH3Ũ����ʱ��ı仯���仯��

��0��25s��25s��40s��NH3�Ļ�ѧ��Ӧ���ʷֱ�Ϊ__________��__________�����ڲ����ԭ����______________________��
�ڸ��¶��´˷�Ӧ��ƽ�ⳣ��Ϊ_______________��
������ͼ�л�����Ӧ��25s������60sʱc(NH3)��ʱ��仯��ͼ���������������������»���ʹ�ô���ʱc(NH3)��ʱ��ı仯ͼ��_______________
(2)������һ���������ܽ�ȼú�����������еĵ�������NOxת��ΪN2����ͼ��ʾ����������ij������(��ҪΪN2��NO��O2)�е�NO�����ʵ�����ֵ�ֱ�Ϊ1��2��2��1��3��1ʱ��NO�ѳ������¶ȱ仯������

������a��ӦCO(NH2)2��NO�����ʵ����ı�ֵ��______��
��CO(NH2)2��NO��Ӧ�Ļ�ѧ����ʽΪ________________��
������a�У�NO����ʼŨ��Ϊ6��10-4mg/m3����A�㵽B�㾭��0.8s����ʱ�����NO���ѳ�����Ϊ______mg/(m3s����
(3)ϣ����ѧ�Ҳ��ø����ӵ����Ե�SYC�մ�(�ܴ���H+)Ϊ���ʣ����������������Ľ����ٶྦྷ��Ĥ���缫��ʵ���˳�ѹ��570�������¸�ת���ʵĵ�ⷨ�ϳɰ�(װ������ͼ)���ٵ缫A�ǵ��ص�____(�����������)�����õ缫�ϵĵ缫��Ӧʽ��_________________��

���𰸡� 6��10-4 mol/(L��s) 3.3��10-4 mol/(L��s) ��Ӧ��Ũ�ȼ�С����Ӧ���ʼ��� 2500(mol/L)-2  �������߸�һ�֣� 3:1 2CO(NH2)2+6NO= 5N2 +2CO2+4H2O 1.5��10-4 ���� N2 + 6H+ + 6e-= 2NH3
�������߸�һ�֣� 3:1 2CO(NH2)2+6NO= 5N2 +2CO2+4H2O 1.5��10-4 ���� N2 + 6H+ + 6e-= 2NH3
��������(1)������ͼ��0��25sNH3�Ļ�ѧ��Ӧ����Ϊ![]() =6��10-4 mol/(L��s)��40sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%�����ݷ���ʽ����Ӧ�İ��������ʵ���Ϊ2mol��25s��40s��NH3�Ļ�ѧ��Ӧ����=
=6��10-4 mol/(L��s)��40sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%�����ݷ���ʽ����Ӧ�İ��������ʵ���Ϊ2mol��25s��40s��NH3�Ļ�ѧ��Ӧ����=![]() =3.3��10-4 mol/(L��s)�����ŷ�Ӧ�Ľ��У���Ӧ��Ũ�ȼ�С����Ӧ���ʼ������ʴ�Ϊ��6��10-4 mol/(L��s) ��3.3��10-4 mol/(L��s) ����Ӧ��Ũ�ȼ�С����Ӧ���ʼ�����
=3.3��10-4 mol/(L��s)�����ŷ�Ӧ�Ľ��У���Ӧ��Ũ�ȼ�С����Ӧ���ʼ������ʴ�Ϊ��6��10-4 mol/(L��s) ��3.3��10-4 mol/(L��s) ����Ӧ��Ũ�ȼ�С����Ӧ���ʼ�����
��2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(g)�����ݻ�ѧ����ʽ��ƽ�ⳣ������д��ƽ�ⳣ��K=![]() �����ݻ�Ϊ100L���ܱ�������ͨ��4mol NH3��2molCO2���÷�Ӧ���е�40sʱ�ﵽƽ�⣬��Ӧ�ﵽƽ��ʱCO2��ת����Ϊ50%�����Ķ�����̼Ũ��0.02mol/L��50%=0.01mol/L��
�����ݻ�Ϊ100L���ܱ�������ͨ��4mol NH3��2molCO2���÷�Ӧ���е�40sʱ�ﵽƽ�⣬��Ӧ�ﵽƽ��ʱCO2��ת����Ϊ50%�����Ķ�����̼Ũ��0.02mol/L��50%=0.01mol/L��
2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(g)
��ʼ��(mol/L) 0.04 0.02 0 0
�仯��(mol/L) 0.02 0.01 0 0.01
ƽ����(mol/L) 0.02 0.01 0 0.01
K=![]() =
=![]() =2500L2mol-2���ʴ�Ϊ��2500��
=2500L2mol-2���ʴ�Ϊ��2500��
����ͼ2�е����߱�ʾ�÷�Ӧ��ǰ25s�ڵķ�Ӧ�����е�NH3Ũ�ȱ仯������Ӧ������70s����������������������£���ͼ����ʵ����ʹ�ô���ʱ���ı䷴Ӧ���ʣ����ı仯ѧƽ�⣬�÷�Ӧ�Ľ�������Ϊ�����ߵ�ת�۵��ں�����40֮ǰ�������������20�����ϣ���ͼΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(2)��CO(NH2)2�ĺ���Խ�ߣ�NO��ת����Խ��NO�ѳ���Խ�ߣ���������a��ӦCO(NH2)2��NO�����ʵ�����ֵ��3��1���ʴ�Ϊ3��1��
��800����900��������NO�ѳ�����������NO����Ϊ��Ӧ��μӷ�Ӧ������ʱ�����طֽ����ɰ�����������̼��������һ����������������ԭ��Ӧ���ɵ�������������NO��Ӧ����N2��ͬʱ���ɶ�����̼��ˮ�����Է�Ӧ����ʽΪ��2CO(NH2)2+6NO�T2CO2+4H2O+5N2���ʴ�Ϊ��2CO(NH2)2+6NO�T2CO2+4H2O+5N2��
��A�㵽BNO�ѳ�����0.55��Ϊ0.75����NO��Ũ�ȱ仯��Ϊ(0.75-0.55)��6��10-4mg/m3=1.2��10-4mg/m3������NO���ѳ�����=![]() =1.5��10-4mg/(m3��s)���ʴ�Ϊ��1.5��10-4��
=1.5��10-4mg/(m3��s)���ʴ�Ϊ��1.5��10-4��
(3)������������������ϵĽ����ٶྦྷ��Ĥ���缫��ʵ���˳�ѹ��570�������¸�ת���ʵĵ�ⷨ�ϳɰ�(װ����ͼ)��������������������B�缫����A�缫��˵���ٵ缫A�ǵ��ص���������������������Ӧ��N2+6e-+6H+�T2NH


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������ǣ�
A�����ڿ���ȼ��ʱ���ۻ�����ȼ�գ�������õIJ�����Na2O2
B�������ڿ������γ���һ�������ܵ�����Ĥ�������ڲ�����������������Ᵽ��
C������Ʒ�������зdz���ͨ������Ϊ���dz�������
D�������ڳ�ʪ�Ŀ������γɵ����������ɣ����ܱ����ڲ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȱ������Ŀǰ��֪�ĵ������������ϰ�����Ҫԭ��Ϊ�����һȫ�������⣬�ҹ��Ѿ���ʼʵʩ����������������ÿ��еĴ�ʩ��
A. ʳ�μӵ�(��) B. ����ӵ�(��)
C. ����ʳ�ú��� D. ע�京��ҩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ÿ���6��26���ǹ��ʽ����գ��䰮������Զ�붾Ʒ�����������ֶ�Ʒ�Ľṹ��ʽ�������й�˵����ȷ����
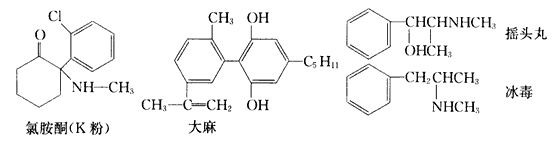
A. ���ֶ�Ʒ�ж����б����������ڷ�����
B. �Ȱ�ͪ����������̼ԭ�ӿ��ܹ�ƽ��
C. 1 mol��������ˮ��Ӧ�������3molBr2
D. ҡͷ�辭����ȥ��Ӧ����ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������̼��������һ�������¿��Ժϳɼ״������Ʊ���ӦΪ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ������˵����ȷ���ǣ�
CH3OH(g)+H2O(g) ������˵����ȷ���ǣ�
A. ���ط�Ӧ�������ܸı䷴Ӧ��
B. ��ѧ��Ӧ���Ⱦ����˷�Ӧ���ڸ������µ����ת����
C. ��CO2���������ʵ�������������ʱ���÷�Ӧ��ֹͣ
D. Ͷ��3molH2�ܵõ�1mol��CH3OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. ����������Һ�������ڣ����������۾����������
B. ʵ�����ϵľƾ����㵹��ȼ��������������ʪ������
C. Ƥ���Ͻ��н϶��Ũ���ᣬ�Ͻ���ˮ��ϴ��
D. �·�մ�ϴ�����Ũ����������Һ���轫���·�������ʢˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. �ԷǼ��Լ����������˫ԭ�ӷ���һ���ǷǼ��Է��� B. �����з����ж����ڻ�ѧ��
C. �Ҽ�һ���Ȧм�ǿ�ȴ� D. s-s �Ҽ���p-p �Ҽ��ĵ�������״�Գ��Բ���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ������������4�ֶ�����Ԫ�أ�����Y��ZΪ����Ԫ�ء�X��Y��Z��W������������Ӧ��ˮ����ס��ҡ�������֮�����������ͼ��ʾ��Ӧ��ϵ��ͼ�С��������������������ܷ�����Ӧ���������ж�һ����ȷ����

A. X��Ԫ�����ڱ��зǽ�������ǿ��Ԫ�� B. Zλ��Ԫ�����ڱ���3����IA��
C. 4��ԭ���У�Yԭ�Ӱ뾶��� D. W������ϼ�Ϊ��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ����2.0 L�����ܱ������г���2 mol SO2��1 mol O2��������Ӧ��
2SO2(g)��O2(g) ![]() 2SO3(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�������ݼ��±���
2SO3(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�������ݼ��±���
t / s | 0 | 2 | 4 | 6 | 8 |
n(SO3) / mol | 0 | 0. 8 | 1. 4 | 1.8 | 1.8 |
����˵����ȷ����
A. ��Ӧ��ǰ2 s ��ƽ������v(O2) �� 0. 4 mol��L��1��s��1
B. ���������������䣬���ѹ����1.0 L��ƽ�ⳣ��������
C. �����¶Ȳ��䣬����������ٳ���2 mol SO2��1 mol O2����Ӧ�ﵽ��ƽ��ʱn(SO3)/n(O2)����
D. ��ͬ�¶��£���ʼʱ�������г���4 mol SO3���ﵽƽ��ʱ��SO3��ת���ʴ���10%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com