
【题目】(1)Na2O2因能发生下列反应被用作补氧剂:2Na2O2+2CO2=2Na2CO3+O2,上述反应中,氧化剂与还原剂的物质的量之比为:___。
(2)某潜艇上有50人,每人每分钟消耗1.12LO2(标况),则一天需___molNa2O2。如用KO2作补氧剂,写出它和CO2反应的化学方程式_____。
①1kgNa2O2和1kgKO2分别和足量的CO2反应,生成O2的体积(同温同压)比为_____。
②等量的CO2分别和足量的Na2O2、KO2反应,生成O2的分子数(同温同压)比为____。
③你认为选用____作补氧剂更为合适,理由是_____。
【答案】1:1 7200mol 4KO2 +2CO2=2K2CO3+3O2 71:117 1:3 KO2 因为KO2产生的O2效率更高
【解析】
(1)在2Na2O2+2CO2=2Na2CO3+O2中只有Na2O2中O元素的化合价变化,Na2O2为氧化剂、还原剂;
(2)反应的相关方程式为2Na2O2+2CO2=2Na2CO3+O2,一天共需要氧气的体积为50×1.12L×60×24=80640L,物质的量为![]() =3600mol,结合反应的方程式计算;根据过氧化钠能和二氧化碳反应生成碳酸钠和氧气的反应来书写KO2与CO2的反应;
=3600mol,结合反应的方程式计算;根据过氧化钠能和二氧化碳反应生成碳酸钠和氧气的反应来书写KO2与CO2的反应;
①根据Na2O2与CO2的反应方程式以及KO2与CO2的反应方程式来计算;
②根据Na2O2与CO2的反应以及KO2与CO2的反应来计算;
③等质量的Na2O2和KO2分别和CO2反应生成的O2体积大小可以选择合适的供氧剂。
(1)在2Na2O2+2CO2=2Na2CO3+O2中只有Na2O2中O元素的化合价变化,为氧化剂、还原剂,由反应及原子守恒可知,氧化剂与还原剂的物质的量之比为1:1;
(2)一天共需要氧气的体积为50×1.12L×60×24=80640L,物质的量为![]() =3600mol,则:
=3600mol,则:
2Na2O2+2CO2=2Na2CO3+O2
2mol 1mol
x 3600mol
x=7200mol
过氧化钠能和二氧化碳反应生成碳酸钠和氧气,用超氧化钾(KO2)代替Na2O2也可起到同样的作用,所以超氧化钾(KO2)也能和二氧化碳反应生成碳酸钾和氧气,反应方程式为4KO2+2CO2=2K2CO3+3O2;
①根据化学方程式2Na2O2+2CO2=2Na2CO3+O2、4KO2+2CO2=2K2CO3+3O2
则2Na2O2~O2,4KO2~3O2,lkgNa2O2和lkgKO2分别和CO2反应,生成的O2体积比(同温同压下)等于物质的量之比,即 :
: ×3=71:117;
×3=71:117;
②根据化学方程式2Na2O2+2CO2=2Na2CO3+O2、4KO2+2CO2=2K2CO3+3O2
则2Na2O2~2CO2~O2,4KO2~2CO2~3O2
假设均为1mol的CO2分别和Na2O2、KO2反应,生成的O2分子数比等于物质的量之比,即为:![]() :
:![]() =1:3;
=1:3;
③根据第(2)小题的答案可以得出:等质量的KO2与Na2O2与足量CO2反应,前者生成的O2更多,即KO2产生的O2效率更高,所以用KO2作补氧剂更为合适。


科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
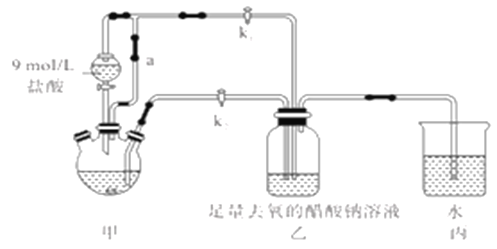
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11)。该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如下图所示(注意:图中的反应式不完整)下列说法正确的是
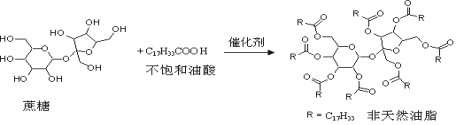
A. 蔗糖酯属于油脂类物质B. 非天然油脂为高分子化合物
C. 该非天然油脂与稀硫酸共热,其水解产物在常温下均为固态D. 该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C。B、C的氢核磁共振谱显示都只有一种氢,且B分子中碳碳键的键长有两种。以C为原料通过下列方案可以制备具有光谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示。
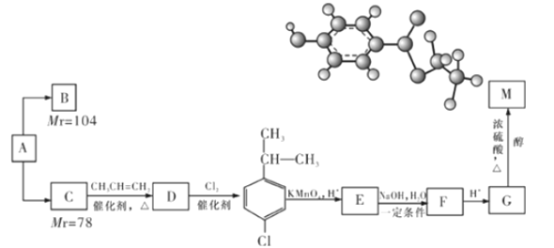
根据上述信息,回答下列问题:
(1)B能使溴的四氯化碳溶液褪色,则B的结构简式为____________,B与等物质的量Br2作用时可能有_________种产物。
(2)C→D的反应类型为______________________。
(3)写出E→F的化学方程式_______________________________。
(4)G分子中的含氧官能团的名称是______________,写出由G反应生成高分子的化学反应方程式___________________________。
(5)M的同分异构体有多种,写出满足以下条件的所有同分异构体的结构简式:
①能发生银镜反应②含有苯环且苯环上一氯取代物有两种③遇FeCl3溶液不显紫色④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上同时连接两个—OH的结构不稳定)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品小Ca2+的浓度。
[配制酸性KMnO4标准溶液]如图是配制250mL酸性KMnO4标准溶液的过程示意图。
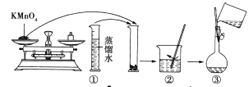
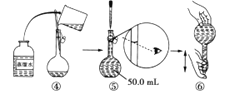
(1)请你观察图示判断其中不正确的操作有(填序号)_____。
(2)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将____(填“偏大”或“偏小”或“无影响”)。
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液。
(3)已知草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O则式中的x=___。
(4)滴定时,根据现象___,即可确定反应达到终点。
(5)经过计算,血液样品中Ca2+的浓度为____mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐含有泥沙以及Ca2+、Mg2+、SO42﹣等杂质,其提纯过程一般经过以下流程:

某兴趣小组按上述方案进行粗盐提纯实验,实验室提供了粗盐样品、稀盐酸、NaOH溶液、BaCl2溶液、Na2CO3溶液等药品以及必备的实验仪器若干。请回答下列问题:
(1)操作①粗盐样品加水之前,需要将大颗粒粗盐变为细小颗粒或粉末,此时在实验室中需要用到的仪器为__________。
(2)操作②、④过滤后的滤液仍有浑浊,需要进行的操作是___________________。
(3)操作③按abc顺序依次加入过量的试剂。若a为NaOH溶液,则c为________。加入c发生反应的离子方程式为_________________________________________________。
(4)加盐酸调溶液pH的目的是________________________________。
(5)步骤⑥操作名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
I.(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。
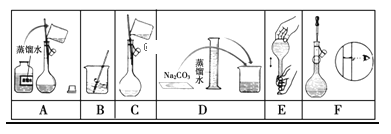
配制过程的先后顺序为(用字母A~F填写)________________。
Ⅱ.若配制1mol/L的稀硫酸溶液500mL
(1)则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为___________mL(计算结果保留一位小数)。如果实验室有10mL 、25mL、50mL量筒,应选用_____________mL规格的量筒最好。
(2)下面操作造成所配稀硫酸溶液浓度偏高的是(_____)
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
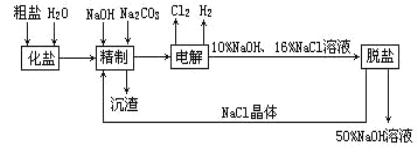
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为_______;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是______
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为______、_______
(4)电解饱和食盐水的总反应化学方程式为_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com