
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������A������������Ԫ�طֱ��γɶ�Ԫ���������ֻ����D�γɵĻ������г�-1�ۣ�B2C5��Ӧ��ˮ������BA3��Ӧ����һ����X��D��ԭ�Ӱ뾶�ڶ����������0��Ԫ�س���)��EԪ��ԭ�ӵ���������������������������3/4������ش��������⣺
(1) X�Ļ�ѧʽΪ_____��������DA�ĵ���ʽΪ________��
(2)Ԫ�صķǽ����� C____________ E(�������� ��<������=�������и����У���˵���ý��۵���ʵ��_______��(�����)��
���⻯��H2E�����Ա�H2Cǿ
���⻯��H2C�����ȶ��Ա�H2Eǿ
���⻯��H2E��ˮ��Һ�����ڿ����л�����
�ܵ�������������C��E����
(3)ʵ���ҽ�BC��BC2��ɵĻ������ͨ����ͼ��ʾװ���У�������֤Ũ����� �����Ա�ϡ�����������ǿ��
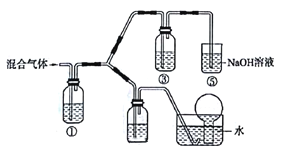
��֪����i��Ũ�����ܽ�����BC������BC2,��ϡ���������BC��
��ii��NaOH��Һ��BC2����ȫ��Ӧ����BC���岻��Ӧ��
a.װ�â١��ڡ�����ʢ�ŵ�ҩƷ��������___________��_______________��______________ ��
b.ͨ��������֮ǰ��Ӧ��ͨ��һ��ʱ��ij����һ�����壬���Ʋ���ͨ��ĸ����������___________(��һ������Ļ�ѧʽ����
c.�ܹ�˵��ʵ���ѳɹ���������________ ��
���𰸡� NH4NO3 ![]() > �ڢۢ� H2O ϡ���� Ũ���� CO2��N2��H2�Ⱥ����𰸾��ɣ� ����������Ȼ��ɫ��������ɫ�����Ϊ����ɫ
> �ڢۢ� H2O ϡ���� Ũ���� CO2��N2��H2�Ⱥ����𰸾��ɣ� ����������Ȼ��ɫ��������ɫ�����Ϊ����ɫ
�����������������A������������Ԫ�طֱ��γɶ�Ԫ���������ֻ����D�γɵĻ������г�-1�ۣ�D��ԭ�Ӱ뾶�ڶ����������D��Na��A��H��B2C5��Ӧ��ˮ������BA3��Ӧ����һ����X��B��N��C��O��X��NH4NO3��EԪ��ԭ�ӵ���������������������������3/4����E��S��
�������������Ϸ�����(1) X�Ļ�ѧʽΪNH4NO3��������NaH�����ӻ��������ʽΪ![]() ��
��
(2)ͬ����Ԫ�ش��ϵ��·ǽ����Լ�����Ԫ�صķǽ�����O> S��
���⻯������Բ��ܱȽϷǽ����Ե�ǿ�����ʢٴ���
���ǽ�����Խǿ���⻯��Խ�ȶ����⻯��H2O�����ȶ��Ա�H2Sǿ���ʢ���ȷ��
���⻯��H2S��ˮ��Һ�����ڿ����л�������˵�����������Դ���S���ʢ���ȷ��
���ǽ�����Խǿ��Խ�����������ϣ���������������O��S���ף�������ȷ��
(3) a.����ʵ��Ŀ�ģ�װ�â�����ˮ��ȥNO�е�NO2��װ����������ˮ���ռ����壬��֪װ����û�а�NO����ΪNO2����������ʢ��ϡ������װ�����������������������壬��֪װ�â۰�NO����ΪNO2�����Ԣ���ʢ��Ũ������
b.Ϊ��ֹ��������NO��ͨ��������֮ǰ��Ӧ��ͨ��һ��ʱ��ij����һ�����壬������ͨ��ĸ����������CO2��N2��H2����
c. ����������Ȼ��ɫ��������ɫ�����Ϊ����ɫ�ܹ�˵��ʵ���ѳɹ���


 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ�Ԫ��(��I��ʽ����)��ʵ��������ȡ����������£�

��1��ʵ���������������________��������Ҫ��������Ϊ________��
��2����ȡ��Ĺ����У��ɹ�ѡ����л��Լ���________(�����)��
A���ƾ�(�е�78 ��) B�����Ȼ�̼(�е�77 ��)
C������(�е�290 ��) D����(�е�80 ��)
��3���ڲ������У���Һ����������ICl(ICl����������������)��Ϊ���������ʣ�ʹ��ȫ�����������Ӧ��������________(�����)��Һ����Ӧ�����ӷ���ʽ___________________��
A��KIO3 B��HClO C��KI D��Br2
��4�����õ���л���Һ�õ�����I2�ķ�����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1Lϡ�����ϡ����Ļ��Һ�������ʵ���Ũ�ȷֱ�Ϊ0.1mol/L��0.4mol/L������û����Һ�м���������ͭ�ۣ������ӷ�Ӧ�ĽǶȷ�������������ܽ�ͭ�۵�����Ϊ�� ��
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��R��X��T��Z��Q��Ԫ�����ڱ��е����λ�����±���ʾ������R�����ڰ�����H2���һ��ϲ�������ը���������ж���ȷ����
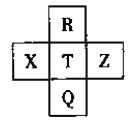
A. �ǽ����ԣ�Z��T��X
B. R��Q�ĵ��������26
C. ��̬�⻯���ȶ��ԣ�R��T��Q
D. ����������ˮ��������ԣ�Q��T
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽���ڳ��������������������Ȼ�茶��巴Ӧ�����������仯��ʵ�鷽����ʵ�鲽����ͼ��ʾ�����������ʵ�鷽���Ͳ���ش��������⣺
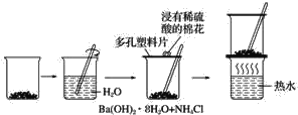
�±���ijѧ����������ʵ�鷽���Ͳ����б�������ʵ����ʵ�ͽ��ۣ�
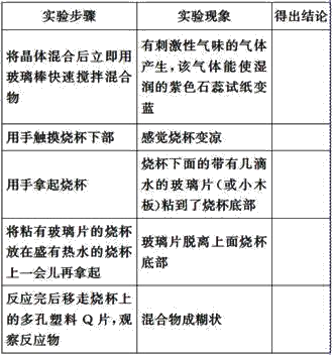
(1)�������ʵ������ó���Ӧ��ʵ����������ϱ��С�_________________��
(2)�û�ѧ����ʽ��ʾ������ӦΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ�������Ȼ��ɰΪ��ʼ�����һϵ�з�Ӧ���Եõ�BF3��BN����ͼ��ʾ��
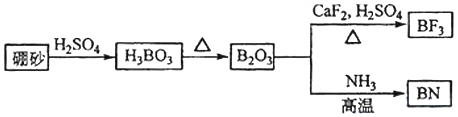
��ش��������⣺
��1��д��B2O3��NH3��Ӧ����BN�Ļ�ѧ��Ӧ����ʽ______________
��2����̬Nԭ�ӵļ۲�����Ų�ʽΪ________��
��3��B��N��O��ȣ���һ������������______��BN��BԪ�صĻ��ϼ�Ϊ_____
��4��д��һ����SO42����Ϊ�ȵ��������__________��
��5��BF3����NH3��Ӧ����BF3NH3��BF3NH3��BF3��NH3֮��ͨ��________���������Ӽ���������λ��������������� ��ϡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.4molX�����0.6molY��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��4X(g)+5Y(g) ![]() nZ(g)+6W(g)��2minĩ������0.3molW������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(L��min)���Լ���
nZ(g)+6W(g)��2minĩ������0.3molW������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(L��min)���Լ���
��1��ǰ2min����W��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ_______________��
��2��2minĩʱY��Ũ��Ϊ_____________________________��
��3����ѧ��Ӧ����ʽ��n=_____________________________��
��4��2minĩ���ָ�����Ӧǰ�¶ȣ���ϵ��ѹǿ�Ƿ�Ӧǰѹǿ��__________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ѡ���װ�û�����(�г�װ������ȥ)��ȷ���ǣ� ��
A | B | C | D | |
ʵ�� | ��ȡ����������CO2���� | ��CCl4��ȡ��ˮ�е�Br2 | ��ȥCO2��������HCl | ����NaCl������Һ�Ʊ�NaCl���� |
װ�û����� |
|
|
|
|
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״������ǿ��������õ�һ������Դ����֪��
��2H2(g)��O2(g)===2H2O(l) ��H1����571.8 kJ��mol��1
��CH3OH(g)��1/2O2(g)===CO2(g)��2H2(g) ��H2����192.9 kJ��mol��1
��1���״�������ȫȼ�յ��Ȼ�ѧ����ʽΪ______________________________
��2����Ӧ���е������仯��ͼ��ʾ���÷�ӦΪ ������ţ��ȷ�Ӧ����H2��________������E1��E2��ʾ��
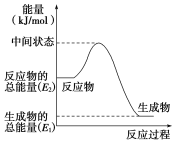
��3��H2(g)��ȼ����Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com