
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
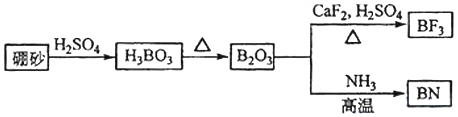
请回答下列问题:
(1)写出B2O3与NH3反应生成BN的化学反应方程式______________
(2)基态N原子的价层电子排布式为________。
(3)B、N、O相比,第一电离能最大的是______,BN中B元素的化合价为_____
(4)写出一个与SO42﹣互为等电子体的微粒__________。
(5)BF3能与NH3反应生成BF3NH3,BF3NH3中BF3与NH3之间通过________(填“离子键”、“配位键”或“氢键”) 结合。
【答案】B2O3+2NH3![]() 2BN+3H2O 2s22p3 N +3 PO43﹣(或CCl4、SiF4) 配位键
2BN+3H2O 2s22p3 N +3 PO43﹣(或CCl4、SiF4) 配位键
【解析】
(1)由工艺流程可知, B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成,反应方程式为B2O3+2NH3![]() 2BN+3H2O;
2BN+3H2O;
答案为:B2O3+2NH3![]() 2BN+3H2O;
2BN+3H2O;
(2)N为7号元素,核外由7个电子,电子排布式为1s22s22p3,基态原子的价层电子排布式为2s22p3。
答案为:2s22p3;
(3)由于氮元素最外层2p轨道半充满,能量低,更稳定,与B、O相比较第一电离能最大;BN中N的第一电离能大于B元素,所以在组成的化合物中N得电子,B失电子,N得三个电子达到稳定结构,为-3价,因此B的化合价为+3价。
答案为:+3;
(4)原子数总数相同、价电子总数相同的粒子,互称为等电子体;SO42﹣5个原子,32个电子,利用位移法,与SO42﹣互为等电子体的微粒有PO43﹣或CCl4或SiF4
答案为:PO43﹣(或CCl4、SiF4)
(5)化合物BF3NH3中,B原子提供空轨道的原子、N原子提供孤电子对,所以B. N原子之间形成配位键;
答案为:配位键。


科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下:
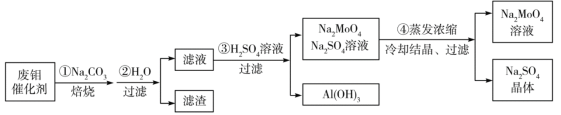
已知:MoO3,Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。
下列有关叙述错误的是
A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑
B.用硫酸浸取②操作后所得滤渣并加入KSCN,溶液变为血红色
C.步骤③中可以用CO2代替硫酸
D.步骤④中可知Na2MoO4溶解度随温度变化较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。

(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,下列说法正确的是
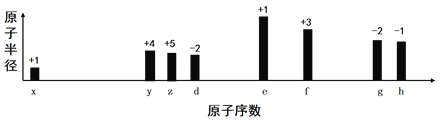
A. z和e的最高价氧化物对应的水化物能相互反应
B. 离子半径:f 3+>e+>d2-
C. g的气态氢化物含有非极性键
D. g的最高价氧化物和水反应生成的化合物是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原字序数依次增大。A可与其他四种元素分别形成二元化合物,其中只在与D形成的化合物中呈-1价;B2C5对应的水化物与BA3反应生成一种盐X;D的原子半径在短周期中最大(0族元素除外);E元素原子的最外层电子数是其次外层屯子数的3/4倍。请回答下列问题:
(1) X的化学式为_____,化合物DA的电子式为________。
(2)元素的非金属性 C____________ E(填“〉” “<”或“=”)下列各项中,能说明该结论的事实有_______;(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④单质与氢气化合C比E容易
(3)实验室将BC和BC2组成的混合气体通入下图所示装置中,相来验证浓硝酸的 氧化性比稀硝酸的氧化性强。
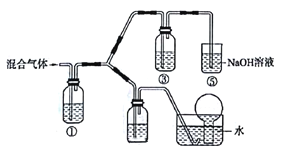
己知:(i)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ii)NaOH溶液勾BC2能完全反应,与BC气体不反应。
a.装置①、②、③中盛放的药品名称依次___________、_______________、______________ 。
b.通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是___________(填一种气体的化学式)。
c.能够说明实验已成功的现象是________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+![]() O2(g) △H=+484kJ/mol
O2(g) △H=+484kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C. H2(g)+![]() O2(g)=H2O(l) △H=+242kJ/mol
O2(g)=H2O(l) △H=+242kJ/mol
D. H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
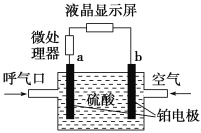
A.呼出气体中酒精含量越高,微处理器中通过的电流越小
B.电解质溶液中的H+移向a电极
C.b为正极,电极反应式为O2+2H2O+4e-=4OH-
D.a极上的电极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向Fe(NO3)2溶液中滴入HI和淀粉混合溶液,溶液变蓝 | 氧化性:Fe2+>I2 |
B | 向3 mL KI溶液中滴加几滴氯水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | Cl2的氧化性比I2的强 |
C | 向Ag2CO3白色悬浊液中滴加少量Na2S溶液,出现黑色沉淀 | Ksp(Ag2S)<Ksp(Ag2CO3) |
D | 苯和液溴在FeBr3的催化下发生反应,将得到的气体直接通入AgNO3溶液中,产生淡黄色沉淀 | 苯和液溴发生取代反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
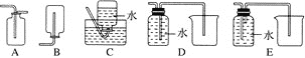
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com