
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )| A. | 原混合溶液中一定含有的离子是OH-、CO32-、AlO2-、SiO32-、Al3+ | |
| B. | AB段反应的离子方程式是H++CO32-═HCO3-,H++HCO3-═CO2↑+H2O | |
| C. | AB段之前反应的离子方程式是AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| D. | K+、Na+两种离子肯定存在其中一种 |
分析 从图中可以看出最初加入盐酸未产生沉淀,则一定有OH-,结合离子共存知识可排除Fe3+、Mg2+、Al3+,且产生沉淀只有部分溶解,则一定有CO32-、AlO2-;
AB段消耗了盐酸,但沉淀未溶解,则溶液中一定有CO32-,AB段应为CO32-与盐酸的反应,反应的离子方程式为:H++CO32-=HCO3-,H++HCO3-═CO2↑+H2O;
根据AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-反应中可知:AlO2-结合H+的能力强于CO32-,AB段之前反应是偏铝酸根离子与氢离子的反应;
结合阴阳离子所带电荷必须守恒,K+、Na+中至少存在一种.
解答 解:A.从图中可以看出最初加入盐酸未产生沉淀,所以一定有OH-,则可以排除Fe3+、Mg2+、Al3+,且产生沉淀只有部分溶解,则一定有CO32-、AlO2-,故A错误;
B.AB段消耗了盐酸,沉淀却未溶解,则一定有CO32-,AB段应为CO32-与盐酸的反应,离子方程式是H++CO32-=HCO3-,H++HCO3-═CO2↑+H2O,故B正确;
C.从AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-反应中可知:AlO2-结合H+的能力强于CO32-,所以AB段之前反应的离子方程式是AlO2-+H++H2O=Al(OH)3↓,故C错误;
D.由于阴阳离子所带电荷必须守恒,因此K+、Na+其中一种肯定存在,故D正确;
故选AC.
点评 本题考查了离子共存的判断、离子推断,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握常见离子的性质及离子共存的条件为,试题培养了学生的分析能力及灵活应用能力.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题

 .
. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
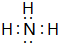 ,结构式为
,结构式为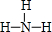 ,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 按系统命名法,有机物 可命名为2,6-二甲基-5-乙基辛烷 可命名为2,6-二甲基-5-乙基辛烷 | |
| B. | 若某高聚物对应的单体只有一种,则此高聚物与单体有相同的最简式 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸( )缩合最多可形成3种二肽 )缩合最多可形成3种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 离子的还原性:C2-<D- | ||
| C. | 氢化物的稳定性:H2C>HD | D. | 离子半径:B+>A3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒有泡沫逸出 | |
| B. | 双氧水中加入二氧化锰气泡产生速率加快 | |
| C. | 合成氨增压,氨产率增大 | |
| D. | 装有NO2的烧瓶置于热水中颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 | |
| C. | CO2与SiO2晶体熔化时,所克服的微粒间相互作用不同 | |
| D. | 短周期元素离子aXn-和bYm-具有相同的电子层结构,若a>b,则n>m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,nCH2=CH-CH=CH2$\stackrel{催化剂}{→}$
,nCH2=CH-CH=CH2$\stackrel{催化剂}{→}$ ,nCH2=CH-CH=CH2$\stackrel{催化剂}{→}$
,nCH2=CH-CH=CH2$\stackrel{催化剂}{→}$
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com