
【题目】25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
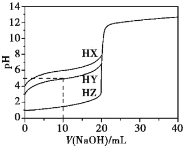
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10—5
C.若将0.1000 mol·L-1酸HX加水稀释,其溶液中c(H+)·c(X-)增大
D.HY与HZ混合,达到平衡时:c(H+)=![]() + c(Z-)+c(OH-)
+ c(Z-)+c(OH-)
【答案】B
【解析】
A、氢氧化钠体积为0时,0.1000molL-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为:HX<HY<HZ,所以相同条件下导电性大小为:HZ>HY>HX,故A错误;
B、当NaOH溶液滴到10mL时,溶质为等物质的量的NaY、HY,则溶液中c(HY)≈c(Y-),HA的电离平衡常数Ka(HY)=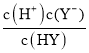 ≈c(H+)=10-pH=10-5,故B正确;
≈c(H+)=10-pH=10-5,故B正确;
C、若将0.1000 mol·L-1酸HX加水稀释,其溶液中c(H+)·c(X-)= Ka(HX)c(HX),温度不变,Ka(HX)不变,而稀释后,c(HX)减小,因此c(H+)·c(X-)= Ka(HX)c(HX)减小,故C错误;
D、HY与HZ混合,溶液中电荷守恒为:c(H+)=c(Y-)+c(Z-)+c(OH-);HA的电离平衡常数为Ka(HY)=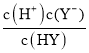 ,c(Y-)=
,c(Y-)=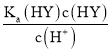 ,c(H+)=
,c(H+)=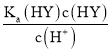 +c(Z-)+c(OH-),故D错误;
+c(Z-)+c(OH-),故D错误;
故选B。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】某化妆品的组分 Z 具有美白功效,其原料从杨树中提取,现可用如下反应制备:
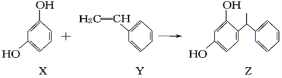
下列叙述正确的是( )
A.X、Y和Z均能使溴水褪色,且原理相同
B.只有Z中含手性碳原子
C.X和Z均能与Na2CO3溶液反应放出CO2
D.X、Y均可作加聚反应的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
|
|
验证化学能转化为电能 | 研究催化剂对化学反应速率的影响 | 实验室制氨气 | 验证非金属性:Cl>C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
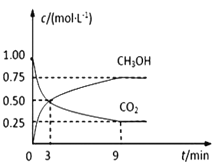
(1)从3 min到9 min,υ(H2)=________;
(2)能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为______________。
(4)平衡时混合气体中CH3OH(g)的体积分数是__________________。
(5)一定温度下,第9分钟时υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分钟时υ正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下重水(D2O)的离子积常数为1.6×10-15,若用定义pH一样的方法来规定pD=-lg{c(D+)},则该温度下,下列叙述正确的是
A.纯净的重水(D2O)中,pD=7
B.溶解有NaCl的重水溶液,其pD=7
C.纯净的重水中(D2O),c(D+)=c(OD-)
D.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度g/l00g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
操作如下:
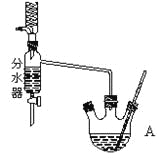
①在50mL三颈烧瓶中投入几粒沸石,将18.5 mL正丁醇和13.4 mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥。
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1 g乙酸正丁酯。
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式___________。
(2)仪器A中发生反应的化学方程式为___________________。
(3)步骤①向三颈烧瓶中依次加入的药品是:__________________。
(4)步骤②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是____________。
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏___,(填“高”或“低”)原因是__。
(6)该实验生成的乙酸正丁酯的产率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。
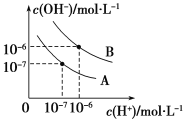
(1)25 ℃时,将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=________。
(2)95 ℃时,将0.02 mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合(假设溶液的体积变化忽略不计),所得混合液的pH=________。
(3)25 ℃时Ksp(AgCl)=1.8×10-10,若向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸(假设溶液的体积变化忽略不计),混合后溶液中Ag+的浓度为________ mol·L-1,pH为________。
(4)25 ℃时Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下欲除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液的pH范围为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 molL-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是
A.该溶液的pH=4
B.此溶液中,HA约有0.1%发生电离
C.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
D.加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2和H2可直接合成甲醇,向一密闭容器中充入CO2和H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①保持温度、体积一定,能说明上述反应达到平衡状态的是____。
A.容器内压强不变 B.3v正(CH3OH)= v正(H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
②测得不同温度时CH3OH的物质的量随时间的变化如图1所示,则ΔH____0(填“>”或“<”)。
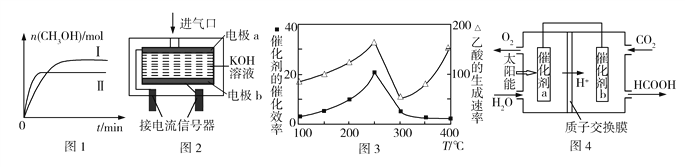
(2)工业生产中需对空气中的CO进行监测。
①PdCl2溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为______。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为______。
(3)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是______。
(4)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c(![]() )=____。(已知:Ksp[Ca(OH)2]=5.6×106,Ksp(CaCO3) =2.8×109)
)=____。(已知:Ksp[Ca(OH)2]=5.6×106,Ksp(CaCO3) =2.8×109)
(5)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图4是通过光电转化原理以廉价原料制备新产品的示意图。催化剂a、b之间连接导线上电子流动方向是____(填“a→b”或“b→a”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com