
(11分)天然气是一种重要的化工原料。
I.2014年5月,我国科学家成功实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、苯、氢气等高值化学品。
(1)苯的二氯代物的同分异构体有 种。
(2)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为 。
(3)已知甲烷、乙烯、氢气燃烧的热化学方程式分别如下:
①CH4(g) +2O2(g) === CO2(g) +2H2O ( l ) ΔH= - 890.3 kJ·mol-1
②C2H4(g)+3O2(g) === 2CO2(g) +2H2O ( l ) ΔH= - 1 306.4 kJ·mol-1
③2H2 (g)+O2 (g) === 2H2O ( l ) ΔH= - 571.6 kJ·mol-1
则2CH4(g) ===C2H4(g) +2H2 (g) 的 ΔH = 。
Ⅱ.甲烷的传统转化利用,第一步制取合成气(CO、H2),第二步用合成气制取甲醇(CH3OH)、二甲醚(CH3OCH3)等。
(4)某温度下,将1mol CH4和1 mol H2O(g)充入容积为0.5 L的密闭容器中,发生如下反应:
CH4(g) +H2O(g)  CO(g) +3H2 (g) ΔH= +206.4 kJ·mol-1
CO(g) +3H2 (g) ΔH= +206.4 kJ·mol-1
当反应达到平衡时,测得其平衡常数K=27。
①CH4的平衡转化率 = 。
②如果其它条件不变,升高温度,CH4的平衡常数 (填“增大”、“减小”或“不变”)。
(5)在一定条件下,合成气发生如下两个主要反应:
CO(g)+2H2(g)=== CH3OH(g) ΔH= -90.1kJ·mol-1
2CO(g)+4H2(g)=== CH3OCH3(g) + H2O(g) ΔH= -204.7kJ·mol-1。
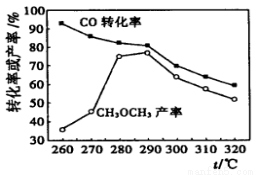
仅根据下图,选择该条件下制取甲醇的最佳温度为 。
(1)3(2分);(2)CH2=CH2+Br2 CH2BrCH2Br(2分);(3)+97.4KJ/mol(2分);
CH2BrCH2Br(2分);(3)+97.4KJ/mol(2分);
(4)①50%(2分);②增大;(5)260℃(2分)。
【解析】
试题分析:(1) 苯的二氯代物的同分异构体有邻位、间位、对位三种不同的位置;(2)乙烯通入溴的四氯化碳溶液中,发生加成反应,产生1,2-二氯乙烷,反应的化学方程式为CH2=CH2+Br2 CH2BrCH2Br;(3)①×2-②-③,整理可得:2CH4(g) =C2H4(g) +2H2 (g) 的 ΔH =+97.4KJ/mol;(4) ①在反应开始时,各种物质的浓度是:c(CH4)= c(H2O)=2mol/L;c(CO)=c(H2 )=0,假设在反应过程中,Δc(CH4) =x,则平衡时各种物质的浓度分别是:c(CH4)= c(H2O)=(2-x)mol/L,c(CO)=xmol/L;c(H2 )=3xmol/L,则根据平衡常数的定义可得:
CH2BrCH2Br;(3)①×2-②-③,整理可得:2CH4(g) =C2H4(g) +2H2 (g) 的 ΔH =+97.4KJ/mol;(4) ①在反应开始时,各种物质的浓度是:c(CH4)= c(H2O)=2mol/L;c(CO)=c(H2 )=0,假设在反应过程中,Δc(CH4) =x,则平衡时各种物质的浓度分别是:c(CH4)= c(H2O)=(2-x)mol/L,c(CO)=xmol/L;c(H2 )=3xmol/L,则根据平衡常数的定义可得: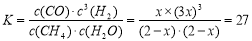 ,解得x=1mol/L,所以CH4的平衡转化率=(1mol/L÷2mol/L)×100%=50%;②由于该反应的正反应是吸热反应,所以如果其它条件不变,升高温度,平衡向吸热的正反应方向移动,所以CH4的平衡常数增大;(5)根据图示可知在低温时CO的转化率较高,而且温度越高,CH3OCH3的产率逐渐升高,这对于甲醇的生产不利,因此应该控制反应温度在260℃。
,解得x=1mol/L,所以CH4的平衡转化率=(1mol/L÷2mol/L)×100%=50%;②由于该反应的正反应是吸热反应,所以如果其它条件不变,升高温度,平衡向吸热的正反应方向移动,所以CH4的平衡常数增大;(5)根据图示可知在低温时CO的转化率较高,而且温度越高,CH3OCH3的产率逐渐升高,这对于甲醇的生产不利,因此应该控制反应温度在260℃。
考点:考查物质的反应类型、同分异构体的种类的判断、反应条件的控制、热化学方程式和化学反应方程式的书写、物质的转化率的计算温度对化学平衡移动的影响的知识。
考点分析: 考点1:化学平衡状态及移动 试题属性

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.汽油、柴油和植物油都属于烃
B.乙烯和苯加入溴水中,都能观察到褪色现象,原因是都发生了加成反应
C.乙醇既能被氧化为乙醛也能被氧化为乙酸
D.淀粉和纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.22.4 L CH4中含有4 NA个C-H键
B.44g CO2含有2NA个氧原子
C.25 ℃,pH=1的硫酸溶液中含有的H+离子数为0.1NA
D.5.6g Fe与足量稀硝酸反应,转移的电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:填空题
(16分)I.一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。

(1)8分钟内,CO的平均反应速率v(CO)=___________(结果保留3位有效数字)。
(2)1100℃时该反应的平衡常数K= (填数值);该温度下,若在8分钟时CO2和CO各增加0.5mol/L,此时平衡 移动(填“正向”、“逆向”或“不”)。
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
CO的浓度(mol/L) | C1 | C2 |
CO2的体积分数 | φ 1 | φ 2 |
体系压强(Pa) | P1 | P2 |
下列说法正确的是___________(填序号);
A.2C1 = 3C2 B.φ1 = φ2 C.P1<P2
II.(4)已知:①Fe(OH)3(aq) Fe3+(aq)+3OH-(aq);ΔH= a kJmol-1
Fe3+(aq)+3OH-(aq);ΔH= a kJmol-1
②H2O(l) H+(aq)+OH-(aq);ΔH=b kJmol-1
H+(aq)+OH-(aq);ΔH=b kJmol-1
请写出Fe3+发生水解反应的热化学方程式: 。
(5)柠檬酸(用H3R表示)可用作酸洗剂,除去水垢中的氧化铁。
溶液中H3R、H2R-、HR2--、R3-的微粒数百分含量与pH的关系如图所示。图中a曲线所代表的微粒数的百分含量随溶液pH的改变而变化的原因是 (结合必要的方程式解释)。调节柠檬酸溶液的pH=4时,溶液中上述4种微粒含量最多的是 (填微粒符号)。

III.(6)高铁酸钠(Na2FeO4)广泛应用于净水、电池工业等领域,工业常用电解法制备,其原理为
Fe+2OH--+2H2O FeO42--+3H2↑
FeO42--+3H2↑
请设计一个电解池并在答题卡的方框内画出该装置的示意图并作相应标注。

其阳极反应式为:________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:选择题
短周期元素甲、乙、丙、丁在周期表的相对位置如下表所示,其中乙为地壳含量最多的元素,则下列判断正确的是
甲 | 乙 | |
丙 | 丁 |
A.甲元素位于元素周期表中第2周期、第V族
B.甲、乙两元素能形成多种化合物
C.原子半径的大小:甲<乙
D.气态氢化物稳定性:丁>丙>乙
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
室温时,pH = 11的稀氨水,下列判断正确的是
A.若升高温度,Kb、Kw均增大
B.用稀盐酸恰好中和时,溶液的pH=7
C.加水稀释,c(NH4+)·c(OH-)增大
D.加入pH = 11的NaOH溶液,NH3·H2O电离平衡逆向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.浓硫酸与铜在加热下反应,硫酸只表现氧化性
B.钠与钾合金可用于快中子反应堆作热交换剂
C.为保护海船的船壳,常在船壳上镶入锡块
D.单晶硅可用于制作光导纤维
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:推断题
选做【化学——有机化学】(12分)1-对甲苯基-3-苯基-2-丙烯-1-酮(以下用M表示)是一种常见的工业原料,其结构简式为: ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):

已知:在稀碱作用下,两分子的醛或酮可以互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
请回答下列问题:
(1)有机物B的名称为 。
(2)物质A、C的关系为 。
a.同系物 b.同分异构体
c.同素异形体 d.分子式相差1个CH2
(3)①~④反应中,属于加成反应的有 。
(4)反应②的化学方程式为 。
(5) 的同分异构体有许多。能与NaHCO3反应,且含有联苯基(
的同分异构体有许多。能与NaHCO3反应,且含有联苯基( 上1个氢原子被取代)的同分异构体共有 种。
上1个氢原子被取代)的同分异构体共有 种。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:填空题
选考[化学---选修2:化学与技术](15分)银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示:

(1)熔炼时被氧化的元素是 ,酸浸时反应的离子方程式为 。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是 。
(2)操作a是 ,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
CuO+ Al2O3 + ↑。
+ ↑。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式 。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,
则V至少为 L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+  Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的 极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com