
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.22.4 L CH4中含有4 NA个C-H键
B.44g CO2含有2NA个氧原子
C.25 ℃,pH=1的硫酸溶液中含有的H+离子数为0.1NA
D.5.6g Fe与足量稀硝酸反应,转移的电子数为0.2 NA
B
【解析】
试题分析:A.气体的体积与气体的物质的量及外界条件有关,只有条件,没有指明气体所处的存在状态,因此不能指出气体的物质的量的多少,也就不能确定含有的化学键的个数,错误;B.44g CO2的物质的量是1mol,由于一个分子中含有2个氧原子,所以1mol的CO2中含有2NA个氧原子,正确;C.25 ℃,pH=1的硫酸溶液中c(H+)=0.1mol/L,但是没有溶液的体积,所以不能确定含有的微粒数目的多少,错误;D.5.6g Fe与足量稀硝酸反应,则Fe变为+3价,所以转移的电子数为0.3 NA,错误。
考点:考查阿伏加德罗常数的计算的知识。
考点分析: 考点1:化学计算 考点2:化学用语及其规律 试题属性

科目:高中化学 来源:2014-2015学年北京市丰台区高三一模理综化学试卷(解析版) 题型:实验题
(14分)铁及其化合物在日常生活中有广泛应用。
(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式 。
(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是
设计实验检验绿矾是否完全变质
(3)利用绿矾制备还原铁粉的工业流程如下:

①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为
②取干燥后的FeCO3样品12.49g ,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量
(4)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
Fe(s)+5CO(g) 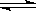 Fe(CO)5(g) ΔH<0
Fe(CO)5(g) ΔH<0

T1 T2(填“>”、“<”或“=”),判断理由是
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca +2ClO
+2ClO =CaCO3↓+2HClO
=CaCO3↓+2HClO
B.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO =CO
=CO +H2O
+H2O
C.Fe3O4与稀HNO3反应:Fe3O4+8H =Fe
=Fe +2Fe
+2Fe +4H2O
+4H2O
D.向NaHCO3溶液中加入少量Ca(OH)2:HCO +Ca
+Ca +OH
+OH =CaCO3↓+H2O
=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:选择题
下图为常温下用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1盐酸和20.00 mL 0.1000 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是

A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+) = c(A—)
C.B点时,反应消耗溶液体积:V(NaOH) <V(HA)
D.当0 mL< V(NaOH) < 20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-) >c(Na+)> c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)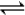 2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:
2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:

①从上表可以推断:该反应的逆反应是 (填“吸”、“放”)热反应。
②此温度下该反应的平衡常数表达式为K=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。

②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)Li2O、Na2O、MgO均能吸收CO2。
①如果寻找吸收CO2的其他物质,下列建议合理的是________。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是__________________ _________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,O 16)
A.标准状况下,22.4 L四氯化碳含有的分子数为nA
B.常温常压下,18g水含有的分子数为 nA
C.1 mol Cu和足量稀硝酸反应产生NO分子数为nA
D.1L1.0 mol·L-1 Na2CO3溶液中含有CO32-数为 nA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:填空题
(11分)天然气是一种重要的化工原料。
I.2014年5月,我国科学家成功实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、苯、氢气等高值化学品。
(1)苯的二氯代物的同分异构体有 种。
(2)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为 。
(3)已知甲烷、乙烯、氢气燃烧的热化学方程式分别如下:
①CH4(g) +2O2(g) === CO2(g) +2H2O ( l ) ΔH= - 890.3 kJ·mol-1
②C2H4(g)+3O2(g) === 2CO2(g) +2H2O ( l ) ΔH= - 1 306.4 kJ·mol-1
③2H2 (g)+O2 (g) === 2H2O ( l ) ΔH= - 571.6 kJ·mol-1
则2CH4(g) ===C2H4(g) +2H2 (g) 的 ΔH = 。
Ⅱ.甲烷的传统转化利用,第一步制取合成气(CO、H2),第二步用合成气制取甲醇(CH3OH)、二甲醚(CH3OCH3)等。
(4)某温度下,将1mol CH4和1 mol H2O(g)充入容积为0.5 L的密闭容器中,发生如下反应:
CH4(g) +H2O(g)  CO(g) +3H2 (g) ΔH= +206.4 kJ·mol-1
CO(g) +3H2 (g) ΔH= +206.4 kJ·mol-1
当反应达到平衡时,测得其平衡常数K=27。
①CH4的平衡转化率 = 。
②如果其它条件不变,升高温度,CH4的平衡常数 (填“增大”、“减小”或“不变”)。
(5)在一定条件下,合成气发生如下两个主要反应:
CO(g)+2H2(g)=== CH3OH(g) ΔH= -90.1kJ·mol-1
2CO(g)+4H2(g)=== CH3OCH3(g) + H2O(g) ΔH= -204.7kJ·mol-1。
仅根据下图,选择该条件下制取甲醇的最佳温度为 。
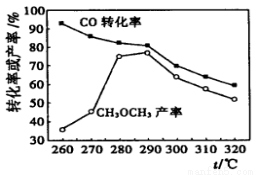
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:选择题
化学“暖手袋”是充满过饱和醋酸钠溶液的密封塑胶袋,袋内置有一个合金片。当合金片轻微震动使溶质结晶,该过程放热。下列说法不正确的是
A.彩色密封塑胶袋能造成白色污染
B.钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠
C.大多数合金比各成分金属硬度大,熔点低
D.任何物理变化和化学变化都伴随着能量的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com