
【题目】现有标准状况下四种气体①8.96L![]() ; ②
; ②![]() 个
个![]() ; ③30.6g
; ③30.6g![]() ; ④
; ④![]() 。下列关系从小到大表示不正确的是( )
。下列关系从小到大表示不正确的是( )
A.体积:④<①<②<③B.密度:①<④<③<②
C.质量:④<①<③<②D.氢原子数:②<④<①<③
【答案】C
【解析】
标准状况下①8.96L![]() 的物质的量为
的物质的量为![]() ,所含氢原子个数为0.4×4=1.6NA,质量为0.4mol×16g/mol=6.4g;②
,所含氢原子个数为0.4×4=1.6NA,质量为0.4mol×16g/mol=6.4g;②![]() 个
个![]() 物质的量为0.5mol,体积为0.5mol×22.4L/mol=11.2L,所含氢原子个数为0.5 NA,质量为0.5mol×36.5g/mol=18.25g;③30.6g
物质的量为0.5mol,体积为0.5mol×22.4L/mol=11.2L,所含氢原子个数为0.5 NA,质量为0.5mol×36.5g/mol=18.25g;③30.6g![]() 物质的量为
物质的量为![]() ,所含氢原子个数为0.9×2=1.8NA,体积为0.9mol×22.4L/mol=20.16L,质量为30.6g;④
,所含氢原子个数为0.9×2=1.8NA,体积为0.9mol×22.4L/mol=20.16L,质量为30.6g;④![]() 体积为0.3mol×22.4L/mol=6.72L,所含氢原子个数为0.3×3=0.9NA,质量为0.3mol×17g/mol=5.1g;
体积为0.3mol×22.4L/mol=6.72L,所含氢原子个数为0.3×3=0.9NA,质量为0.3mol×17g/mol=5.1g;
A.体积大小关系为:④<①<②<③,故A正确;
B.同温同压下气体密度比等于摩尔质量之比,所以密度大小关系为:①<④<③<②,故B正确;
C.质量大小关系为:④<①<②<③,故C错误;
D.氢原子个数大小关系为:②<④<①<③,故D正确;
故答案为C。


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、ⅤA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的核外电子有__种不同的空间运动状态。
(2)P、S、Cl的第一电离能由大到小的顺序为__。
(3)M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是__(填字母)。
a.分子空间构型相同
b.中心原子杂化类型相同
c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含__个σ键。
③配合物T与[M(NH3)5(H2O)]Cl3组成元素的种类和数目相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2molAgCl。则T的化学式为___。
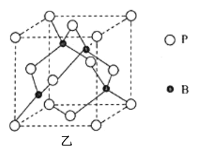
(4)如图甲为硼酸晶体的片层结构,其中硼的杂化方式为__。H3BO3在热水中比冷水中溶解度显著增大的主要原因是__。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子相连构成几何体的空间构型为__(填“立方体”或“正四面体”或“正八面体”)。已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为__pm(列式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达,正确的是
A.钠投入水中的离子方程式: Na+2H2O=Na++2OH-+H2↑
B.一水合氨的电离方程式: NH3H2O![]() NH4++OH-
NH4++OH-
C.硫酸铜溶液和氢氧化钡溶液反应的离子方程式反应:Ba2++SO42=BaSO4↓
D.氯气溶于水的离子方程式:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的吸收液用三室膜电解技术处理,原理如图所示.下列说法错误的是

A.电极a为电解池阴极
B.阳极上有反应HSO3—-2e—+H2O=SO42—+3H+发生
C.当电路中通过1mol电子的电量时,理论上将产生0.5mol H2
D.处理后可得到较浓的H2SO4和NaHSO3产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲探究NH3的催化氧化反应,按如图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。

(1)NH3催化氧化的化学方程式是____。
(2)甲、乙两同学分别按如图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是___。
②乙观察到装置F中只有白烟生成,白烟的成分是___(填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:___。
(3)为帮助乙实现在装置F中也观察到红棕色气体,如何改进___。
(4)为实现该反应,也可用如图所示的装置替换原装置中虚线框部分。
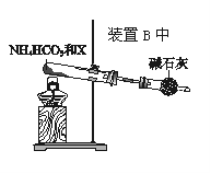
化合物X为__;NH4HCO3的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为___________________________,
表示该反应中和热的离子方程式为_________________________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式__________________________________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 648 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393 kJ/mol
2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1 480 kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
_________________________________________________________________。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为______________________________________________。
(5)已知反应2HI(g)===H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________________kJ。
(6)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
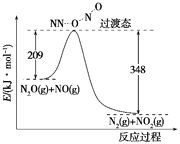
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
⑴ΔH4=__kJ·mol-1。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为__(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
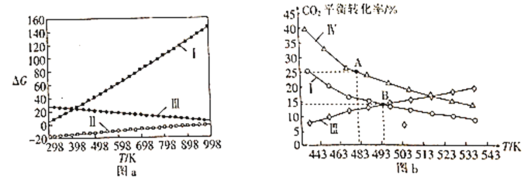
⑶在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2,分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH3__0(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)__pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)__(填“大于”“小于”或“等于”)K(Ⅲ)。
⑷向一体积为1L的密闭容器中通入H2和CO2,只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=![]() ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。
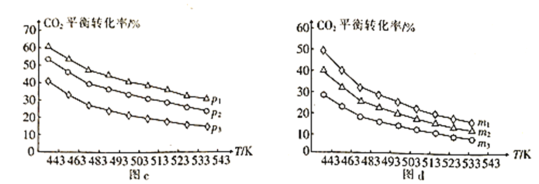
①图c中压强从大到小的顺序为__,图d中氢碳比m从大到小的顺序为__。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=__(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com