
 是由一种单体缩聚而成的,该单体的键线式为
是由一种单体缩聚而成的,该单体的键线式为 )滴入Na2CO3溶液中发生的化学方程式:
)滴入Na2CO3溶液中发生的化学方程式:
 是由一种单体缩聚而成的,其单体为CH3CHOHCOOH;
是由一种单体缩聚而成的,其单体为CH3CHOHCOOH; )滴入Na2CO3溶液,-COOH、酚-OH均反应;
)滴入Na2CO3溶液,-COOH、酚-OH均反应; 是由一种单体缩聚而成的,其单体为CH3CHOHCOOH,其键线式为
是由一种单体缩聚而成的,其单体为CH3CHOHCOOH,其键线式为 ,故答案为:
,故答案为: ;
; )滴入Na2CO3溶液,-COOH、酚-OH均反应,则发生的反应为
)滴入Na2CO3溶液,-COOH、酚-OH均反应,则发生的反应为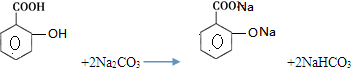 ,
, ;
;| 水 |
| △ |
| 水 |
| △ |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
| A、c(OH-)>c(Na+)+c(H+) |
| B、由水电离出的c(OH-)=1.0×10-12mol?L-1 |
| C、与等体积pH=2的醋酸混合后所得溶液显碱性 |
| D、与等体积0.01mol?L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷、乙醇、乙二醇 |
| B、苯、苯酚、苯乙烯 |
| C、甲醛、乙酸、甲酸甲酯 |
| D、甲烷、乙烯、乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②③ |
| C、①④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
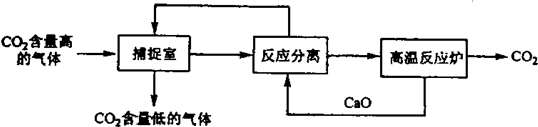
| A、能耗大是该方法的一大缺点 |
| B、整个过程中,既有氧化还原反应又有非氧化还原反应 |
| C、“反应分离”环节中,分离的基本操作是过滤 |
| D、整个过程中,有2种物质可以循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
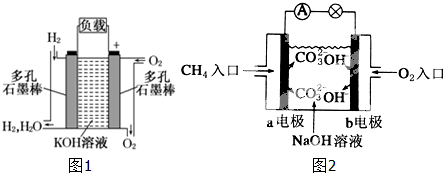
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | ||||
| 4 | B | H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com