
下图表示某些化工生产的流程(部分反应条件和产物略去)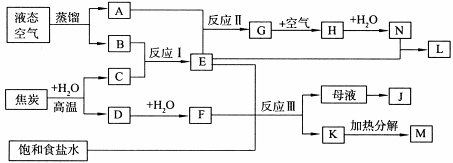
(1)反应Ⅰ需在500℃进行,其主要原因是 。
(2)G转化为H的过程中,需要不断补充空气,其原因是 。
(3)写出反应Ⅲ的化学方程式 。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是 (填序号)。
a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称 。
(8分)
(1)此温度下催化剂活性最高(1分) ;
(2)使NO不断转化为NO2,提高原料的利用率(1分)
(3)NaCl+ NH3+CO2+H2O= NaHCO 3↓+ NH4Cl(1分)
(4)ac(2分)
(5)合成氨工业、氨催化氧化法制硝酸、侯德榜制碱法(1个1分,共3分)
解析试题分析:结合图片空气中主要是氮气与氧气,焦炭与水生成CO和氢气,结合反应Ⅰ、Ⅱ可知A.O2;B. N2;C. H2;D. CO;E. NH3;F. CO2;G. NO;H. NO2; J.NH4Cl;K. NaHCO 3;L.NH4NO 3;M. Na2CO 3;N. HNO 3;
(1)此温度下催化剂活性最高提高转化效率;
(2)使2NO+ O2=2NO2,提高原料的利用率。
(3)侯氏制碱法的主要反应:NaCl+ NH3+CO2+H2O= NaHCO 3↓+ NH4Cl。
(4)通入氨气增大NH+4的浓度,使NH4Cl更多地析出;使NaHCO 3转化为Na2CO 3,提高析出的NH4Cl的纯度;
(5)根据工艺流程可知主要有合成氨工业、氨催化氧化法制硝酸、侯德榜制碱法。
考点:本题以化学工艺流程为基础,考查了元素及化合物性质、工业合成知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
X、Y是短周期同主族元素,Z是过渡元素,化合物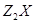 、
、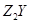 可发生如下转化。
可发生如下转化。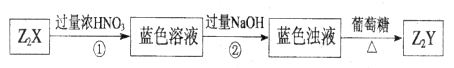
(1)X的元素符号为_________,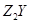 的化学式为_________。
的化学式为_________。
(2)蓝色溶液中含有的阴离子是_______________。
(3)过程②中发生反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题: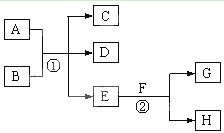
(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊
试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,
反应①的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是中学常见的5种化合物,A、B是金属氧化物且A是红棕色固体,元素X、Y、Z是中学化学中常见的单质,相关物质间的关系如下图所示。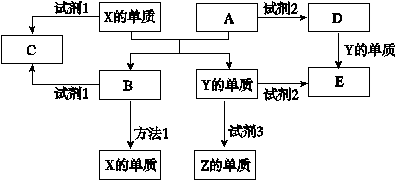
(1)工业上得到单质X的冶炼方法1是 。
(2)单质X与试剂1、单质Y与试剂2都能产生Z单质,试剂3是生活中常见的液体,请写出Y与试剂3 反应的化学方程式是 。
(3)若试剂1是NaOH溶液,单质X与试剂1反应的离子方程式 。
(4)若试剂2是盐酸。
①如何检验D物质中的金属阳离子 。
②将D的饱和溶液滴加到沸水中得到有丁达尔效应的分散系,用离子方程式和平衡移动理论说明产生这种分散系的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分:
| 族 周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列各反应现象所归纳的元素性质不正确的是
| A.将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出。不能说明钠的金属性比铜弱 |
| B.用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝。说明氯元素的非金属性比碘元素强 |
| C.把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出。说明Cl的非金属性比S强 |
| D.将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol。说明这三种金属的活泼性为:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别可以是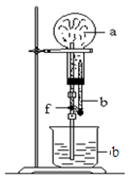
| | 干燥气体a | 液体b |
| A | NO2 | 水 |
| B | C12 | 饱和食盐水 |
| C | NH3 | 水 |
| D | CO2 | 4 mol·L—1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列实验现象,所得结论正确的是( )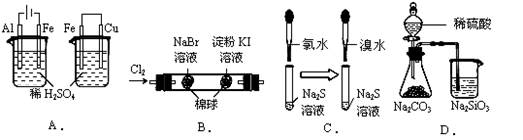
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>Ⅰ2 |
| C | 左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 | 氧化性:Cl2>Br2>S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表所列各组物质中,不能通过一步反应实现如图所示转化的是
| 物质 选项 | a | b | c |
| A | Si | Na2SiO3 | SiO2 |
| B | Fe | FeCl3 | FeCl2 |
| C | AlCl3 | Al(OH)3 | NaAlO2 |
| D | Na2O2 | Na2CO3 | NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com