
 (12 分)某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在下方的括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。
(12 分)某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在下方的括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。
并写出有关离子方程式
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

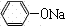 +CO2+H2O→
+CO2+H2O→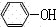 +NaHCO3;
+NaHCO3;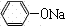 +CO2+H2O→
+CO2+H2O→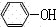 +NaHCO3;
+NaHCO3;| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,震荡. | 出现白色浑浊 出现白色浑浊 |
苯酚常温下溶解度不大 苯酚常温下溶解度不大 |
| 步骤2:取少量C的稀溶液分装b、c两只试管,往b试管 滴入过量饱和溴水,振荡. 滴入过量饱和溴水,振荡. |
产生白色沉淀 | 苯酚与溴发生取代反应,生成三溴苯酚白色沉淀. 苯酚与溴发生取代反应,生成三溴苯酚白色沉淀. |
| 步骤3:往c试管 滴入几滴FeCl3溶液,振荡 滴入几滴FeCl3溶液,振荡 |
溶液变为紫色 溶液变为紫色 |
C与加入的试剂发生显色反应. |
| 1 |
| 3 |
| 1 |
| 2 |
| 1000mL |
| 25.00mL |
| 1 |
| 3 |
| 1 |
| 2 |
| 1000mL |
| 25.00mL |
- 3 |
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分) Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL0.100mol·L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、烧杯、玻璃棒外,还需要 ▲ 。
(2)配制上述溶液需准确称取Na2S2O3固体的质量为 ▲ g。
(3)另取废水40.00mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得BaCrO4沉淀,沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO全部转化为Cr2O;再加入过量KI溶液进行反应,然后在反应溶液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液24.00mL。已知有关反应的离子方程式为:①Cr2O+6I-+14H+==2Cr3++3I2+7H2O;②I2+2S2O===2I-+S4O。试计算该工厂废水中Ba2+的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省潮州市高三第二次高考模拟考试理综化学试卷(解析版) 题型:填空题
某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:

相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
|
难溶物 |
Ksp |
|
Ca3(AsO4)2 |
6.8×10-19 |
|
CaSO4 |
9.1×10-6 |
|
FeAsO4 |
5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
|
污染物 |
H2SO4 |
As |
|
废水浓度 |
29.4g/L |
1.6g·L-1 |
|
排放标准 |
pH 6~9 |
0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=
。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O HAsO42-+OH-,该步水解的平衡常数(25℃)为:
(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为:
(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com