
����Ŀ������һ������ɫ�Ľ�������ѧ�����ȶ�����;�㷺�� ��ҵ���Ը�����[��Ҫ�ɷ��� Fe(CrO2)2]Ϊԭ��ұ���������ǿ������ Na2Cr2O7���乤����������ͼ��ʾ��

 ��1��Na2Cr2O7 �и�Ԫ�صĻ��ϼ�Ϊ ����֪ Cr(OH)3 Ϊ�����������д������뷽��ʽ ��
��1��Na2Cr2O7 �и�Ԫ�صĻ��ϼ�Ϊ ����֪ Cr(OH)3 Ϊ�����������д������뷽��ʽ ��
��2��д���������ȷ�Ӧ��ȡ���Ļ�ѧ����ʽ: ��
�Լ� c ͨ���������� (����д����) ��
��3���ữ�����У���ѡ�������ԭ���� ��
��4������ a ����Ҫ�ɷ��� Na2SO4��10H2O��������ͼ���������� aΪ �� �����ˡ�
���𰸡���1��+6��H��+CrO2-+H2OCr(OH)3Cr3++3OH����
��2��2Al+Cr2O3![]() Al2O3+2Cr �� CO��C��H2����д���ֶ�������
Al2O3+2Cr �� CO��C��H2����д���ֶ�������
��3�������е�Cl���ᱻ����������Cl2����4������Ũ�������½ᾧ��
��������
�����������1�����ԣ�2�ۣ�Na�ԣ�1�ۣ����ϼ۴�����Ϊ0����Cr�Ļ��ϼ��ǣ�6�ۣ��ο�Al(OH)3�ĵ��룬H��+CrO2-+H2OCr(OH)3Cr3++3OH������2���������Ļ�ԭ��ǿ����˷�Ӧ����ʽΪ��2Al+Cr2O3![]() Al2O3+2Cr ���õ��������������Ȼ�ԭ������������̿��CO��H2����3����6��Cr����ǿ�����ԣ��ܰ�Cl��������Cl2�������ж���Ⱦ��������4���õ����нᾧˮ�ľ��壬��������Ũ������ȴ�ᾧ�ķ�����
Al2O3+2Cr ���õ��������������Ȼ�ԭ������������̿��CO��H2����3����6��Cr����ǿ�����ԣ��ܰ�Cl��������Cl2�������ж���Ⱦ��������4���õ����нᾧˮ�ľ��壬��������Ũ������ȴ�ᾧ�ķ�����


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�CO��H2��Ӧ���ɼ״�(CH3OH)(����ΪCu2O/ZnO)��CO(g)��2H2(g)![]() CH3OH(g)��������и��⣺
CH3OH(g)��������и��⣺
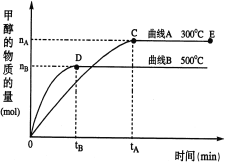
(1)��Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽ��K�� �������¶ȣ�Kֵ (����������������С������������)��
(2)��500�����ӷ�Ӧ��ʼ��ƽ�⣬v(H2)�� ��(����ͼ�г��ֵ���ĸ��ʾ)
(3)�������������������£��Դ���E�����ϵ���ѹ����ԭ����1/2�������йظ���ϵ��˵����ȷ���� (�����)��
a��H2��Ũ�ȼ���
b��CH3OH�����ʵ�������
c������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
d������ƽ��ʱn(H2)/n(CH3OH)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�������ȷ�Ң������������ϵ���ǣ� ��
ѡ�� | ������ | ������ |
A | ��ҵ�ϳɰ��ķ�Ӧ�ڸ����½��� | N2��3H2 |
B | ����ˮ��Һˮ�����ɽ��� | ���������ھ�ˮ |
C | SiO2������������ | HF��Һ�����ò����Լ�ƿʢ�� |
D | �ȵķǽ����Աȵ�ǿ | ���ԣ������ǿ������ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���֪��C��s��+O2��g���TCO2��g����H1
2C��s��+O2��g���T2CO��g����H2 C��s��+CO2��g���T2CO��g����H3
��H3�릤H1�ͦ�H2��Ĺ�ϵ��ȷ���ǣ�������
A. ��H3=��H1+2��H2 B. ��H3=��H1+��H2
C. ��H3=��H1-2��H2 D. ��H3=��H2-��H1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵķ�����ȷ����
�� | �� | �� | ���������� | ���������� | |
A | NaOH | H2SO4 | BaCO3 | Al2O3 | CO2 |
B | KOH | HCl | NaCl | Na2O | CO |
C | NaOH | H2SO3 | CaCl2 | CuO | SO2 |
D | Na2CO3 | HNO3 | CaCO3 | MgO | SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ�ܵ�������������ڵ���ʵ���
A������ B������ C��������̼ D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����У�S<0����
A. �ܽ�������������ˮ�� B. �������Ȼ���ϳ��Ȼ��
C. �����������ϳ��Ȼ��� D. NH4HCO3(s)���ȷֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ��������ʱ����������ˮ���ռ����ǣ� ��
A.NO2
B.H2
C.O2
D.NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����
A. ��2H2��g����O2��g����2H2O��g����H��-483��6kJ��mol��1����H2ȼ����Ϊ241��8kJ��mol��1
B. ��C��ʯī��s����C�����ʯ��s����H>0����ʯī�Ƚ��ʯ�ȶ�
C. ��֪NaOH��aq����HCl��aq����NaCl��aq����H2O��l����H��-57��4kJ��mol��1����20��0gNaOH������ϡ������ȫ�кͣ��ų�28��7kJ������
D. ��֪2C��s����2O2��g����2CO2��g����H1��2C��s����O2��g����2CO��g����H2������H1>��H2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com