
【题目】课外小组的同学利用下图装置研究铜与稀硝酸的反应。
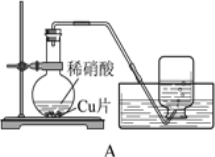
(1)铜与稀硝酸的反应中,硝酸体现了______(填“氧化性”或“还原性”)。
(2)铜与稀硝酸反应的化学方程式是______。
(3)集气瓶收集到无色气体,该气体的主要成分是______。
(4)某同学认为上述实验不足以证明反应生成的是该气体,他的理由是______(结合化学方程式说明)。
【答案】氧化性 3Cu+8HNO3(稀)= 3Cu(NO3)2+ 4H2O + 2NO ↑ NO 3NO2+H2O=2HNO3+NO
【解析】
铜与稀硝酸的反应生成硝酸铜、NO和水,结合氧化还原反应的规律和二氧化氮的性质分析解答。
(1)铜与稀硝酸的反应生成硝酸铜、NO和水,N元素的化合价部分降低,硝酸体现了氧化性和酸性,故答案为:氧化性;
(2)铜和稀硝酸反应的方程式为:3Cu+8HNO3=3Cu(NO3 )2+2NO↑+4H2O,故答案为:3Cu+8HNO3=3Cu(NO3 )2+2NO↑+4H2O;
(3)铜与稀硝酸的反应生成硝酸铜、NO和水,NO为无色气体,该无色气体为NO,故答案为:NO;
(4)若生成的气体是二氧化氮,用排水法收集时,二氧化氮和水反应生成一氧化氮,也会收集到无色气体,因此不能证明铜和稀硝酸反应一定生成NO,故答案为:3NO2+H2O═2HNO3+NO。


科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式__________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)![]() SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
3SiH2Cl2(g)![]() SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
则反应4SiHCl3(g)![]() SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
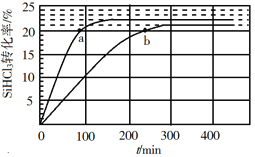
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]()
![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中![]() 随n(NaOH)的变化如图所示。下列说法正确的是
随n(NaOH)的变化如图所示。下列说法正确的是

A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是
A.用惰性电极电解饱和食盐水的化学方程式:2NaCl+H2O![]() H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
B.苯和液溴的反应C6H6+Br2![]() C6H4Br2+H2
C6H4Br2+H2
C.氯化铁水解的离子方程式:Fe3++3H2OFe(OH)3+3H+
D.稀硝酸滴在石灰石上:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l) △H=+267kJmol-1
N2(g)+H2O(l) △H=+267kJmol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJmol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJmol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400-500℃和常压下的催化氧化: 2SO2 + O2![]() 2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
A.反应温度选择400-500℃是该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果
B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑
C.为提高SO2的转化率,应适当提高O2的浓度
D.使用催化剂是为了加快反应速率,提高SO3产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com