
����Ŀ������H2SO4��H2O2��Һ�еμ�һ������KMnO4��Һ����Ӧ��ʼ������Һ��Mn2+��Ũ��c����ʱ��t�ı仯���仯��ijѧ������ʵ��ǰ��Ϊ��Mn2+��Ũ��c��ʱ��t�Ĺ�ϵ��ͼ����ʾ������ʵ������õ��Ľ����ͼ����ʾ����ش�����������

��1��д��H2O2��KMnO4��Ӧ�Ļ�ѧ����ʽ ��
��2��Oa�ε�����Ϊ ��
��3��ab�ε����弰ab�ζ���ԭ��Ϊ ��
��4��bc�ε�����Ϊ ��
 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᡢ��ξ����ڵ���ʣ����ǵ�ˮ��Һ�д��ڸ���ƽ�⣮
��1����ˮ����ѧ������
��������ʵ��֤����ˮ���������������ĸ��ţ���
A����ˮ�ܸ��Ȼ�������Һ��Ӧ��������������
B�������£�0.1molL��1��ˮpHΪ11
C����������ֽ�
D�������£�0.1molL��1�Ȼ����Һ��pHΪ5
�����з����У�����ʹ��ˮ����̶��������������ĸ��ţ���
A��ͨ�백�� B�����������Ȼ������� C����ˮϡ�� D�����������Ȼ�粒���
��2������ʹ�������ѧ������
��0.1molL��1NaOH��Һ�ֱ�ζ������Ϊ20.00mL��Ũ�Ⱦ�Ϊ0.1molL��1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߣ�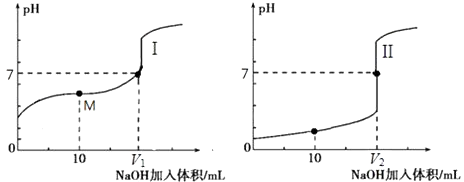
�ٵζ���������������I����II������
�ڵζ���ʼǰ��������Һ����ˮ�������c��H+�������� ��
��V1��V2�Ĺ�ϵ��V1V2�����������=����������
��M���Ӧ����Һ�У������ӵ����ʵ���Ũ���ɴ�С��˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С������ͼ1װ�ý���ʵ�飬�Իش��������⣮ 
��1������ʼʱ����K��a���ӣ���B���ĵ缫��ӦʽΪ ��
��2������ʼʱ����K��b���ӣ��ܷ�Ӧ�����ӷ���ʽΪ�й�������2��ʵ�飬����˵����ȷ���ǣ�����ţ� ��
����Һ��Na+��A���ƶ�
������״����B������2.24L���壬����Һ��ת��0.2mol����
�۷�Ӧһ��ʱ������������ɻָ������ǰ����ʵ�Ũ��
�ܴ�A�����ݳ���������ʹʪ���KI������ֽ����
��3����С��ͬѧ��Ϊ�����ģ�ҵ�����ӽ���Ĥ�����ռ�ķ�������ô������������ͼ2װ�õ���������Һ����ȡ������������������������أ�
�ٸõ��۵�������ӦʽΪ �� ��ʱͨ�������ӽ���Ĥ��������������ڡ�����С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����������ĵ缫��ӦʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㣮һ����Һ̬�£�N2H4��Ϊȼ�� �ĵ��װ����ͼ��ʾ���õ���Կ����е�����Ϊ���������� KOH ��ҺΪ�������Һ������ ���ڸõ�ص�����������ǣ� �� 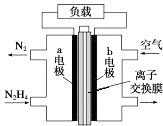
A.b ��������ԭ��Ӧ
B.a ���ķ�ӦʽΪ N2H4��4e���TN2��+4H+
C.�ŵ�ʱ�������� b �������������� a ��
D.���е����ӽ���Ĥ��ѡ�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���к͵ζ���ȥ�ⶨij�ռ�Ĵ��ȣ�ʵ��������£�
��i�����ƴ���Һ��ȡ�� 5.0g �����ռ���Ʒ�����ʲ����ᷴӦ�����Ƴ� 250mL ��Һ��
��ii���� 0.2000molL��1 ������ζ������ռ���Һ��ʵ��������� A���ü�ʽ�ζ���ȡ�����ռ���Һ10.00mL��ע����ƿ�У�����ָʾ����B���ô��ⶨ ����Һ��ϴ��ʽ�ζ��ܣ�C��������ˮϴ�ɾ��ζ��ܣ�D��ȡ����ʽ�ζ����ñ������� ��Һ��ϴ����Һע����ʽ�ζ��̶ܿȡ�0������2��3cm�����ٰ���ʽ�ζ��̶ܹ��ã�����Һ�����̶ȡ�0����0���̶����£�E�����ζ����Ƿ�©ˮ��F����ȡ��ƿ�����ظ� ����һ�Σ�G������ƿ���ڵζ������棬�ߵα�ҡ����ƿֱ���ζ��յ㣬���µζ���Һ��Ŀ̶ȣ�
��1���ٵζ���������ȷ˳���ǣ��������д���� ��
�ڸõζ�������Ӧѡ�õ�ָʾ���ǣ� ��
����G���������ȷ���յ㣿
��2�����ݴ���
ʵ�������� | ������Һ���V��mL�� | ����������Һ��� V��mL�� |
1 | 22.4 | 10.00 |
2 | 22.60 | 10.00 |
3 | 26.00 | 10.00 |
4 | 22.50 | 10.00 |
�������������ݣ�ѡȡ���ʵ����飬��������ռ���Һ��Ũ��Ϊ �� �ռ� �Ĵ���Ϊ
��3�����в������ᵼ��ʵ����ƫ�͵���������ţ���
�ټ�ʽ�ι�������ˮϴ����û���ô���Һ��ϴ ����ƿ������ˮϴ����û���ô���Һ��ϴ ���յ����ʱ���ӣ��ζ�ǰ����ȷ�� ����ʽ�ζ��ܼ������û���ų����ζ�����ʧ ����ʱ��ƿ��Һ�ηɽ����� ����ʽ�ζ���������ˮϴ����û���ñ�Һ��ϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1molL��1�������Ϊ100mL������һԪ��HX��HY����Һ�У��ֱ����NaOH���壬lg ![]() �����NaOH�����ʵ����ı仯��ͼ��ʾ������������ȷ���ǣ� ��
�����NaOH�����ʵ����ı仯��ͼ��ʾ������������ȷ���ǣ� �� 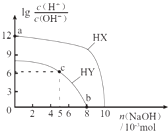
A.HX����������HY
B.a����ˮ�������c��H+��=10��12 molL��1
C.c����Һ�У�c��Y������c��HY��
D.b��ʱ���ǡ����ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������д������
A. �ù��Ϊ10mL����Ͳ��ȡ6.2mL��Һ��
B. ��ҩ����ֽ�۰ѷ�ĩ״ҩƷ�����Թܵĵײ�
C. ����ʱ��������ĩ��Ӧ������������ֽ��
D. ���û���ԹܼУ�������ʱ�ֳ��Թܸ������Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Һ���������ӵ�Ũ���������M�����Ϊ�� ��
�������� | NO3�� | SO42�� | H+ | M |
Ũ��/��molL��1�� | 2 | 1 | 2 | 1 |
A.Cl��
B.Ba2+
C.Na+
D.Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. Ħ���ǽ�һ����Ŀ��ԭ�ӡ����ӻ���ӵ���������ɳ���������ϵ������һ��������
B. ���ʵ����ȱ�ʾ���ʵ������ֱ�ʾ���ʵ�����
C. �����ӵ�������12 kg 12C�к��е�̼ԭ����Ŀ
D. 1 mol H2O���10 mol����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com