
����Ŀ���������ƣ�Na2FeO4����һ�ֶ�ܡ���Ч����������ɫˮ��������
��1��Na2FeO4����Ԫ�صĻ��ϼ���______�ۣ�Na2FeO4�ܸ�ˮ�������õ���________�ԡ�
��2����Na2FeO4��ˮ������ɱ��ʱ�õ���Fe3+���Ծ�ˮ��Fe3+��ˮԭ����______________���ü�Ҫ��������������
��3����ҵ�Ͽ���FeCl3��NaOH ��NaClO����������һ�������·�Ӧ�Ƶ�Na2FeO4����ƽ��Ӧ�����ӷ���ʽ��_____Fe3+ +_____OH��+____ClO�� =_____FeO42��+ _____![]() + ______Cl�� ��____________������Ϊ________������Ӧ������ת����0.5 mol���ӣ���ԭ��������ʵ���Ϊ________ mol��
+ ______Cl�� ��____________������Ϊ________������Ӧ������ת����0.5 mol���ӣ���ԭ��������ʵ���Ϊ________ mol��
���𰸡�+6 ǿ���� Fe3+��ˮ��Ӧ���ɽ���Fe(OH)3��������ˮ�������� 2��10��3��2��5 H2O��3 ClO�� 0.25
��������
(1)���ݻ��ϼ۵Ĵ�����Ϊ0�����з�����+6�۵�������Ԫ�ص����̬���к�ǿ�������ԣ�
(2) Fe3+ˮ�������Fe(OH)3�����������ˮ�������ﲢ���۳������ݴ˽��
(3)���ݵ�ʧ�������غ�������غ�����ƽ�����ݻ��ϼ۱仯���ж���������������������ת�Ƶ��ӵı�����ϵ�����йؼ��㡣
(1)�������л��ϼ۵Ĵ�����Ϊ0��Na2FeO4����Ԫ��Ϊ+1�ۣ���Ԫ��Ϊ-2�ۣ�����Ԫ��Ϊ+6�ۣ�+6�۵�������Ԫ�ص����̬���к�ǿ�������ԣ�
��ˣ�������ȷ���ǣ�+6��ǿ������
(2) Fe3+�����������ӣ��ܽ��ˮ�����������������Fe(OH)3���壬��������ˮ�������ﲢ���۳�����������Ծ�ˮ��
��ˣ�������ȷ���ǣ�Fe3+��ˮ��Ӧ���ɽ���Fe(OH)3��������ˮ�������
(3)��Ϊ����FeCl3��NaOH��NaClO����������һ�������·�Ӧ�Ƶ�Na2FeO4����2molʧȥ6mol���ӣ�������Ϊ2mol Na2FeO4��ʧȥ��6mol�����ܱ�3molNaClO�õ���NaClO��+1����Ԫ�ػ�ԭΪ-1�ۣ���3molCl-������2mol FeCl3�е�6molCl-��һ��������9molNaCl����Ӧ������10mol NaOH��������ԭ�ӵ��غ����֪���������л�����5molH2O��
��ƽ��Ӧ�����ӷ���ʽΪ��2Fe3+ +10OH��+3ClO�� =2FeO42��+5 H2O + 3Cl���������ӷ���ʽ��֪��ClO���õ��ӻ��ϼ۽��ͣ���������������ԭΪCl-�����Ի�ԭ����ΪCl-��ÿ����1mol Cl-��ת��2mol���ӣ�������Ӧ������ת����0.5 mol���ӣ�������Cl-�����ʵ���Ϊ0.25mol��
��ˣ�������ȷ���ǣ�2��10��3��2��5 H2O��3 ��ClO�� ��0.25��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl��������������ɱ�����ȡ�
��1����Na2SO3��Һ��μ��뵽CuCl2��Һ�У��ټ�������Ũ������ȣ��õ�CuCl�������÷�Ӧ�б�������������______���ѧʽ����
��2��Ϊ�ⶨ�Ƶ�CuCl��Ʒ�Ĵ��ȣ���������ʵ�飺a����ȡ0.5000 g��Ʒ������ʢ�� 20 mL����FeCl3��Һ�Ͳ��������ƿ�У�����ҡ����b������Ʒ�ܽ��ˮ50 mL��c��������0.2000 mol��L-1 Ce(SO4)2����Һ������Ӧ��ȫ����¼���ı���Һ������� d���ظ�����a��c 2�Σ���¼���ı���Һ��ƽ�����Ϊ25.00 mL��
��֪��CuCl + Fe3+ = Cu2+ + Fe2+ + Cl�� Fe2+ + Ce4+ = Fe3+ + Ce3+
������100 mL 0.2000 mol��L-1 ��Ce(SO4)2����Һʱ����Ҫ�IJ����������ձ�����Ͳ����������100 mL����ƿ�⣬����Ҫ_______��
��ͨ������ȷ������Ʒ��CuCl�Ĵ��ȡ�______
�۽��в���cʱ����������������CuCl�Ĵ���_______����ƫ����ƫС������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ�������ʣ����������ת����ͼ��ʾ��

�Իش�
��1��д��B�Ļ�ѧʽ________��D�Ļ�ѧʽ_________��
��2��д����Eת���F�Ļ�ѧ����ʽ____________________________________��
��3������G��Һ�������ӵ��Լ�Ϊ__��д��������Ӧ�����ӷ���ʽ____________��
��4��ijͬѧȡB����Һ�ữ�����⻯�ص�����Һ���ڿ����з���һ�����Ϊ��ɫ��д���������仯������ص����ӷ���ʽ__________________��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008��ŵ������ѧ��������������Ǯ��������λ��ѧ�ң��Ա������Ƿ��ֺ��о�����ɫӫ�⵰�ס�ӫ�����Ƿ������ʵĻ��ʣ� 5-�Ȼ�ӫ������5-�Ȼ�������ӫ�����ڼ�����������ǿ�ҵ���ɫӫ�⣬���ǹ㷺Ӧ����ӫ������ȡ��� ��
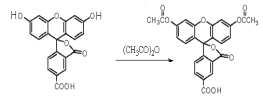
![]()
����˵������ȷ���� �� ��
A. 5-FAMת��Ϊ5-CFDA����ȡ����Ӧ
B. 5-FAM�ķ���ʽΪC21H12O7
C. 5-FAM��5-CFDA ��1mol�ֱ�������NaOH��Һ��Ӧ��5-CFDA���ĵ�NaOH ���ʵ�����
D. ʵ���Ҽ���5-FAM��5-CFDA����NaHCO3 ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42���������еļ��֣��������Һ�м���ijŨ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ��ʾ������˵�� һ����ȷ���ǣ� ��

A. һ������H+��Mg2+��Al3+��NH4+��һ��������Na+��SO42����Fe3+
B. һ������H+��Al3+��NH4+��SO42�������ܴ���Na+��Mg2+
C. ��Һ��c��H+����c��Al3+����c��Mg2+��Ϊ1��1��2
D. ��Һ��c��H+��/c��SO42������ֵС�ڵ���2/9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ,����������ȷ���ǣ� ��
A. 2.24L�����к��еĹ��ۼ���Ϊ0.7NA
B. 23 g���ڿ����г��ȼ�����ɹ�������ʱ�����õ�����Ϊ2NA
C. 11g����ˮ(3H216O)�к��е�������Ϊ6NA
D. 0.1molN2��0.3molH2��һ�������³�ַ�Ӧ������NH3������Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ּ����ṩ�������̵ܹ��������ȼ�ϵ�صĹ���ԭ����ͼ��ʾ�����е������ҺΪ���л�����A��ϡ���ᡣ�����йر�����ȷ���ǣ� ��

A. ͨ��N2�ĵ缫�����ĵ缫��ӦʽΪN2-6e-+8H+=2NH4+
B. ��װ���ܽ���ѧ��ת��Ϊ���ܣ�������A ΪNH4Cl
C. ���Ӵ�ͨ��N2�ĵ缫�����������õ�������ͨ��H2�ĵ缫
D. ��Ӧ�����е������Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ������������ ��
A. ˮ�����c( H+)= 1xl0-13 mol/L����Һ�У�K+��Na+��SiO32����SO42��
B. ��ʹʯ�����ɫ����Һ�У�Na+��Fe3+��SO42����Cl��
C. ![]() =lxl0��13 moI/L����Һ�У�Ba2����ClO����Cl����NO3��
=lxl0��13 moI/L����Һ�У�Ba2����ClO����Cl����NO3��
D. ��������Ӧ�ų�H2����Һ�У�K+��Fe2+��SO42����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ��ǣ� ��
A. Cu![]() CuS
CuS ![]() CuCl2
CuCl2
B. NaCl ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
C. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() ��ˮFeCl3
��ˮFeCl3
D. MgCO3![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com