
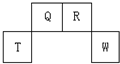
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
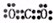 ,R为N,N的气态氢化物为NH3,NH3的结构式为
,R为N,N的气态氢化物为NH3,NH3的结构式为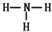 ,故答案为:第三周期ⅥA族; Al>C>N;
,故答案为:第三周期ⅥA族; Al>C>N; 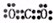 ;
; 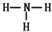 ;
;

科目:高中化学 来源: 题型:
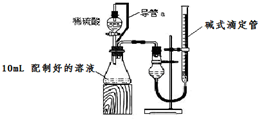 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钋Po--简单立方堆积--52%--6 |
| B、钠Na--钾型--74%--12 |
| C、锌Zn--镁型--68%--8 |
| D、银Ag--铜型--74%--8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
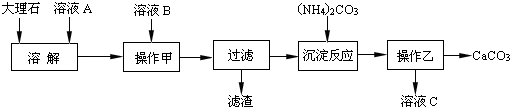
查看答案和解析>>
科目:高中化学 来源: 题型:
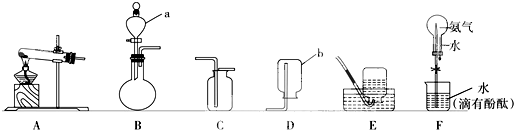
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
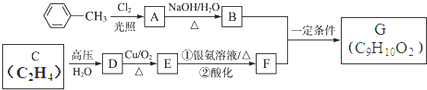
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com