
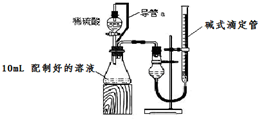
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.| 250mL |
| 25mL |
| 4.24g |
| 5.0g |


科目:高中化学 来源: 题型:
| A、煤燃烧时将部分化学能转化为热能 |
| B、镁条燃烧时将部分化学能转化为光能 |
| C、TNT爆炸时将部分化学能转化为动能 |
| D、电解熔融Al2O3时将部分化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+Na2CO3+H2O=2NaHCO3 |
| B、Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO |
| C、2CO2+2Na2O2=2Na2CO3+O2 |
| D、SiO2+CaO=CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
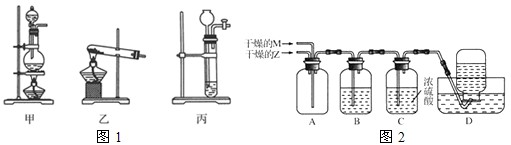
| n(Z) |
| n(M) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cu |
| △ |
| KMnO4 |
| H+ |
| A |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇的沸点低于丁醇;正丁烷的沸点高于异丁烷;并且丁醇的沸点高于丁烷 |
| B、用甘氨酸H2NCH(CH3)CHCOOH和H2NCH(CH3)COOH缩合最多可形成4种二肽 |
| C、乙醛、柠檬酸、甲酸、乙酸甲酯、葡萄糖、麦芽糖都能发生银镜反应 |
| D、C4H8属于烯烃类的同分异构体中存在顺反异构的只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
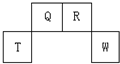 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com