
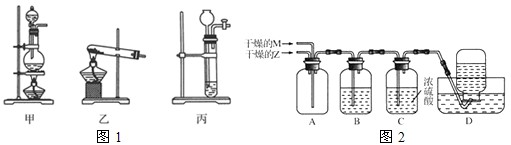
| n(Z) |
| n(M) |
| 3 |
| 8 |
| 3 |
| 8 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、0.5 mol?L-1 醋酸 |
| B、0.5 mol?L-1盐酸 |
| C、0.5 mol?L-1硫酸 |
| D、0.5 mol?L-1硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2溶液与过量的NaHCO3溶液混合:Ba2++OH-+HCO3-=BaCO3↓+H2O |
| B、次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| D、氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变情况下,增加A(g)的质量,则a(A)降低,a(B)升高 |
| B、其他条件不变情况下,增加压强,a(A)升高,则x>3 |
| C、其他条件不变情况下,升高温度,a(A)降低,则△H>0 |
| D、其他条件不变情况下,加入催化剂,则平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O/H+ |
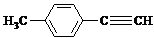 )的一条路线如下:
)的一条路线如下: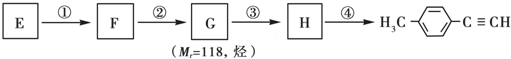
查看答案和解析>>
科目:高中化学 来源: 题型:
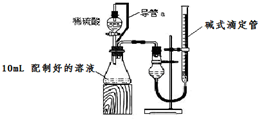 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钋Po--简单立方堆积--52%--6 |
| B、钠Na--钾型--74%--12 |
| C、锌Zn--镁型--68%--8 |
| D、银Ag--铜型--74%--8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com