
| A、CO2+Na2CO3+H2O=2NaHCO3 |
| B、Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO |
| C、2CO2+2Na2O2=2Na2CO3+O2 |
| D、SiO2+CaO=CaSiO3 |


 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
| A、铝片不需要特殊的保护方法 |
| B、炒过菜的铁锅未清洗易生锈 |
| C、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| D、镀锌铁比镀锡铁耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水显碱性:NH3?H2O?NH4++OH- |
| B、硫酸氢钠溶液显酸性:NaHSO4=Na++H++SO42- |
| C、Na2S溶液显碱性:S2-+2H2O?H2S+2OH- |
| D、判断反应混乱度变化:X(g)+Y(s)?M(l)+N(g)△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2溶液与过量的NaHCO3溶液混合:Ba2++OH-+HCO3-=BaCO3↓+H2O |
| B、次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| D、氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变情况下,增加A(g)的质量,则a(A)降低,a(B)升高 |
| B、其他条件不变情况下,增加压强,a(A)升高,则x>3 |
| C、其他条件不变情况下,升高温度,a(A)降低,则△H>0 |
| D、其他条件不变情况下,加入催化剂,则平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
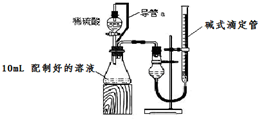 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com