
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.| 2.3g |
| 46g?mol-1 |
| 68.34kJ |
| 0.05mol |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、100 mL 3.0 mol?L-1NaCl溶液 |
| B、75mL 1.0 mol?L-1CaCl2溶液 |
| C、150 mL 1.0mol?L-1KCl溶液 |
| D、100 mL 0.5 mol?L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O/H+ |
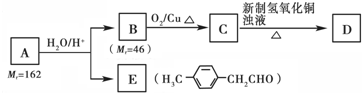
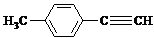 )的一条路线如下:
)的一条路线如下: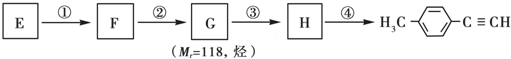
查看答案和解析>>
科目:高中化学 来源: 题型:
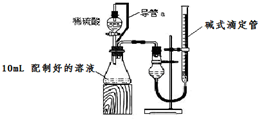 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
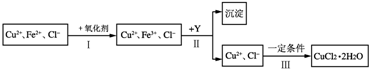
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
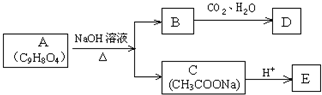
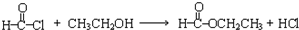 ,写出草酰氯(结构式:
,写出草酰氯(结构式: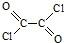 )与足量有机物D反应的化学方程式:
)与足量有机物D反应的化学方程式: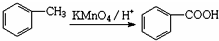 ,由邻甲基苯酚经过两步反应可生成有机物A:邻甲基苯酚→中间产物→有机物A,请写出“中间产物”的结构简式
,由邻甲基苯酚经过两步反应可生成有机物A:邻甲基苯酚→中间产物→有机物A,请写出“中间产物”的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com