
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3—→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是
| A.生成40.0 L N2(标准状况) |
| B.有0.250 mol KNO3被氧化 |
| C.转移电子的物质的量为1.25 mol |
| D.被还原的N原子的物质的量为3.75 mol |
科目:高中化学 来源: 题型:单选题
Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质。一种制备Na2FeO4的反应原理为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是 ( )
| A.反应中氧化剂是Na2O2,还原剂是FeSO4 |
| B.生成2 mol Na2FeO4时,反应中共有8 mol电子转移 |
| C.Na2FeO4的氧化性大于Na2O2 |
| D.Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3的物质的量之比为3:5,则参加反应的Cl2与NaOH的物质的量之比为( )
| A.8:11 | B.3:5 | C.1:2 | D.9:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下: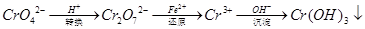
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| B.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1 mol H2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4 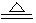 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
| A.CO2是氧化产物 |
| B.H2C2O4在反应中被氧化 |
| C.H2C2O4的氧化性强于ClO2的氧化性 |
| D.ClO2作水处理剂时,利用了其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有Fe2+、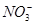 、Fe3+、
、Fe3+、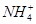 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
| A.氧化剂和还原剂的物质的量之比为1∶8 |
| B.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
C.每1 mol 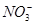 发生氧化反应,转移8 mol e- 发生氧化反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可生成CuH。下列叙述中错误的是 ( )。
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应可能产生H2 |
| C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O |
| D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是( )
| A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
| B.元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
| C.元素的原子得失电子后,一定形成8电子的稳定结构 |
| D.有单质参加或生成的反应一定属于氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com