
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A. 反应在前50s的平均速率为v(PCl3)=0.0032molL﹣1s﹣1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11molL﹣1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,达到平衡前v(正)<v(逆)
D. 相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率>80%
【答案】D
【解析】A项,由表中数据可得,前50s平均速率v(PCl3)=0.16mol÷2.0L÷50s=0.0016molL﹣1s﹣1,故A错误;B项,由表中数据可得,原平衡c(PCl3)=0.20mol÷2.0L=0.10molL﹣1,因为保持其他条件不变,升高温度,再次平衡时,c(PCl3)=0.11molL﹣1,所以升温平衡右移,△H>0,故B错误;C项,根据表中数据列三段式得:
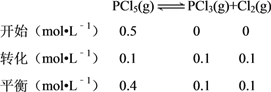
所以平衡常数K=![]() =
=![]() =0.025,若相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,则Q=
=0.025,若相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,则Q=![]() =
=![]() =0.02,Q<K,此时平衡正向移动,v(正)>v(逆),故C错误;D项,原平衡可等效为初始状态为1.0mol PCl3、1.0mol Cl2,PCl3的平衡转化率为(1.0-0.20)÷1.0×100%=80%,相同温度下,若起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到的平衡与原平衡不等效,因为增大压强平衡向逆反应方向移动,所以PCl3的转化率增大,故PCl3的转化率>80%,D正确。
=0.02,Q<K,此时平衡正向移动,v(正)>v(逆),故C错误;D项,原平衡可等效为初始状态为1.0mol PCl3、1.0mol Cl2,PCl3的平衡转化率为(1.0-0.20)÷1.0×100%=80%,相同温度下,若起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到的平衡与原平衡不等效,因为增大压强平衡向逆反应方向移动,所以PCl3的转化率增大,故PCl3的转化率>80%,D正确。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A. 28 g MgCO3和NaHCO3混合固体中的CO32-离子数为NA
B. 1 mol I2与4 mol H2反应生成的HI分子数为2NA
C. 1 mol Al溶于含1 mol NaOH的溶液,电子转移数为3NA
D. 3.4 g H2O2中含有的共用电子对数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置进行中和热的测定,请回答下列问题:

(1)做一次完整的中和热测定实验,温度计需使用________次。
(2)把温度为15.0 ℃,浓度为0.5 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成溶液的比热容c=4.18 J · g-1 · ℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.4 | ΔH1 |
HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①计算上述第一组实验测出的中和热ΔH1=_________________________。
②写出HCl+NH3·H2O的热化学方程式:____________________________________。
③两组实验结果差异的原因是______________________________________。
(3)计算反应NH3·H2O(aq)=NH4+(aq)+OH-(aq)的焓变ΔH=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)在医药方面有重要应用.下列关于 ![]() Bi和
Bi和 ![]() Bi的说法正确的是( )
Bi的说法正确的是( )
A.![]() Bi和
Bi和 ![]() Bi都含有83个中子
Bi都含有83个中子
B.![]() Bi和
Bi和 ![]() Bi互为同位素
Bi互为同位素
C.![]() Bi和
Bi和 ![]() Bi的核外电子数不同
Bi的核外电子数不同
D.![]() Bi和
Bi和 ![]() Bi分别含有126和127个质子
Bi分别含有126和127个质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.除去苯中的苯酚,可加浓溴水后过滤
B.除去乙醇中的水,可加入硫酸铜直接蒸馏
C.除去乙酸乙酯中的乙酸,可加入饱和碳酸钠溶液后分液
D.除去乙烷中的乙烯,可直接通入酸性高锰酸钾溶液洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3分解产生了氨气 |
D. | 漂白粉在空气中久置 | 变成块状固体 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用二氧化锰和浓盐酸共热的方法制取氯气,反应中二氧化锰被还原为MnCl2 . 根据要求回答下列问题. 
(1)A,B,、C三套装置中,应选用的装置是(选填“A”,“B”,“C”);
(2)写出实验室用上述方法制取氯气的化学方程式;
(3)为了防止氯气污染环境,图中所示的溶液甲为 , 在该溶液中发生反应的化学方程式 .
(4)利用该原理和装置进行试验,制得的氯气中往往含有的杂质有 , 可依次通入到除去.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com