
【题目】某研究性学习小组在查阅资料时发现,化工厂常用氨气来检验氯气是否泄漏,于是他们设计实验来探究氯气与氨气之间的反应。该小组设计的实验装置如下图

实验可用药品有:a.二氧化锰 b.浓盐酸 c.浓氨水 d.氯化铵 e.碱石灰 f.浓硫酸 g.饱和食盐水 h.NaOH 固体 i.消石灰
请回答下列问题:
(1)实验室制备氨气有多种方法。通常用加热固体混合物的方法制备氨气,反应的化学方程式是_____________,本实验中装置A 烧瓶内的固体可选用_______________(填上述给定药品的序号)。
(2)装置E 的烧瓶中发生反应的离子方程式是_____________________。
(3)装置D 中盛装的药品是________________(填序号),装置C的作用是_________________。
(4)通人B 装置的两根导管左边的较长、右边的较短,其目的是_________________________。
(5)实验中观察到装置B 内出现浓厚的白烟,并在容器壁上凝结成白色固体,白色固体的化学式为__________。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O e MnO2+4H++2Cl-
CaCl2+2NH3↑+2H2O e MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和食盐水 干燥氯气 让氨气和氯气充分反应 NH4Cl
Mn2++Cl2↑+2H2O 饱和食盐水 干燥氯气 让氨气和氯气充分反应 NH4Cl
【解析】
本题主要考查的是实验室中氯气与氨气的制法。(1)固体氯化铵、氢氧化钙加热生成氨气、氯化钙和水;装置A为固体与液体不加热制取氨气;
(2)实验室用二氧化锰与浓盐酸加热制取氯气;
(3)氯化氢易挥发,制取的氯气中含有氯化氢和水蒸气,用装置D除去氯化氢,用装置C除去水蒸气;
(4)氨气的密度小于空气,氯气的密度大于空气,以此方法通入气体,可形成逆流,让氨气和氯气充分反应;
(5)氨气具有还原性,氯气具有氧化性,氨气与氯气反应生成氯化铵和氮气,氯化铵是白色固体。
(1)氯化铵、氢氧化钙加热生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;装置A为固体与液体不加热制取氨气,固体可以选取碱石灰;
CaCl2+2NH3↑+2H2O;装置A为固体与液体不加热制取氨气,固体可以选取碱石灰;
(2)二氧化锰与浓盐酸加热生成氯化锰、氯气和水,离子反应方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以可以用饱和食盐水除去氯气中的氯化氢,浓硫酸具有吸水性,可以干燥氯气;
(4)氨气的密度小于空气,氯气的密度大于空气,以此方法通入气体,可形成逆流,让氨气和氯气充分反应;
(5)氨气具有还原性,氯气具有氧化性,其反应方程式为:8NH3+3Cl2===6NH4Cl+N2,白色固体是NH4Cl。


科目:高中化学 来源: 题型:
【题目】按要求写出下列化学用语:
(1)H2S在溶液中的电离方程式:____________________________________________________。
(2)用离子方程式解释NaClO溶液显碱性的原因:_______________________________________。
(3)铬原子的外围电子排布式:________________________。
(4)画出HF分子间的氢键:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“铁与水蒸气的反应实验”。

请回答该实验中的问题。
(1)写出该反应的反应方程式:__________________________________;并指明该氧化还原反应的还原剂是____________,氧化剂是______________。
(2)实验前必须对整套装置进行气密性检查,操作方法是_______________________________。
(3)圆底烧瓶中盛装有水,该装置受热后的主要作用是____________________________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是__________________。
(4)酒精灯和酒精喷灯点燃的顺序是__________________________________,为什么?___________________________________________________________________。
(5)干燥管中盛装的物质是________________________,作用是_______________________。
(6)试管中收集的气体是__________,如果要在A处玻璃管处点燃该气体,则必须对该气体进行____________________,方法是________________________________。这一操作的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去下列物质中所含的杂质,所选用的试剂或操作方法错误的是( )
序号 | 物质 | 杂质 | 试剂或方法 |
A |
|
| 加热至恒重 |
B |
|
| 通入过量二氧化碳 |
C |
|
| 加入过量铜粉并过滤 |
D |
|
| 通入氯气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的相对分子质量为84,分子中含有碳碳双键,且分子中只有一种类型的氢。
(1)A的结构简式为____________________。
(2)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。

C的化学名称是_______________;E2的结构简式是_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:N2(g)+O2(g)![]() 2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
A. 能使该反应物中活化分子数和活化分子百分数同时增大的方法只能是使用催化剂
B. 到达平衡状态时,v(N2)=2v(NO)
C. 在1000℃时,此反应能自发进行
D. 一定温度下,该反应达到平衡状态后,增加N2的浓度,化学反应平衡常数变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N-苯基苯甲酰胺 广泛应用于药物,可由苯甲酸
广泛应用于药物,可由苯甲酸 与苯胺
与苯胺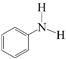 反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
已知:
溶剂 物质 | 水 | 乙醇 | 乙醚 |
苯甲酸 | 微溶 | 易溶 | 易溶 |
苯胺 | 易溶 | 易溶 | 易溶 |
N-苯基苯甲酰胺 | 不溶 | 易溶于热乙醇,冷却后易于结晶析出 | 微溶 |
下列说法不正确的是
A. 反应时断键位置为C-O键和N-H键
B. 洗涤粗产品用水比用乙醚效果更好
C. 产物可选用乙醇作为溶剂进行重结晶提纯
D. 硅胶吸水,能使反应进行更完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )

A. X极是电源负极,Y极是电源正极
B. a极的电极反应是2Cl--2e-=Cl2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com