
| A、溶解的铁粉为2.8g |
| B、原溶液中c(SO42-)=0.5mol/L |
| C、原混合溶液中c(H+)=1.2mol/L |
| D、原溶液中n(NO3-)=0.08mol |
| 1.92g |
| 64g/mol |
| 0.0448L |
| 22.4L/mol |
| 0.05mol |
| 0.1L |
| 1.92g |
| 64g/mol |
| 8 |
| 3 |
| 0.0448L |
| 22.4L/mol |
| 0.08mol+0.04mol |
| 0.1L |
| 1.92g |
| 64g/mol |
| 2 |
| 3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
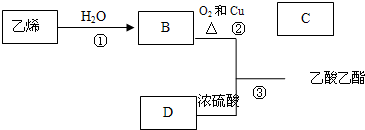
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、0.012mol/L |
| B、0.15mol/L |
| C、0.10mol/L |
| D、0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、①②④ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液胶体和浊液 |
| C、根据水溶液能否导电将化合物分为电解质和非电解质 |
| D、碱性氧化物一定是金属氧化物.金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解加适量BaCL2溶液过滤 |
| B、溶解加适量CaCL2溶液过滤 |
| C、溶解加适量Ca(OH)2溶液过滤 |
| D、溶解加适量盐酸加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com