
| A、全部 | B、①⑤ |
| C、②③④ | D、②③④⑤ |


科目:高中化学 来源: 题型:
| A、强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| B、同一弱电解质溶液,温度不同时,导电能力不同 |
| C、强电解质在溶液中完全电离,但溶液中存在电离平衡 |
| D、强电解质在固态或液态时,可能不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电镀时,镀件接电源的正极,电镀材料接电源负极 |
| B、在船身上装锌块可避免船体遭受腐蚀 |
| C、充电时,把铅蓄电池的负极接在外电源的正极 |
| D、碱性氢氧燃料电池工作时,负极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
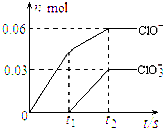 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、反应中转移电子的物质的量是0.21mol |
| B、ClO3-的生成是由于温度升高引起的 |
| C、苛性钾溶液中KOH的质量是16.8g |
| D、氯气被还原成0.06molClO-和0.03molClO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3、Fe2O3都能和酸反应生成盐和水,故都是碱性氧化物 |
| B、CO、NO、SO2都是大气污染气体,在空气中都能稳定存在 |
| C、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液变红 |
| D、Na2O与Na2O2中,阴阳离子之比相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,3.2 g O3所含电子数为1.2 NA |
| B、常温常压下,34g H2O2中含有质子的数目为34 NA |
| C、标准状况下,11.2 L CO与11.2 L O2混合所含原子数为2NA |
| D、0.1 mol CO32-,所含电子数为38NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2在阴极上被氧化 | ||||
| B、可选用铁作为阳极材料 | ||||
| C、负极的电极反应式:N2+6e-+6H+═2NH3 | ||||
D、该过程的总反应式是N2+3H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
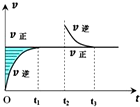 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )| A、Z和W在该条件下一定不为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等 |
| D、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com