
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,33.6L氦气所含的原子数目是3NA
B. 2.2gKHCO3与Mg3N2的混合物中含有的质子数目为1.1NA
C. 0.3molNaHSO4固体在熔融状态下所含的SO42-数目为0.3NA
D. 25℃时,1LpH=12的Na2CO3溶液中含有Na+的数目为0.02NA
【答案】B
【解析】A项,标准状况下n(He)=![]() =1.5mol,所含原子物质的量为1.5mol,A项错误;B项,若2.2g全为KHCO3,2.2gKHCO3中所含质子物质的量为
=1.5mol,所含原子物质的量为1.5mol,A项错误;B项,若2.2g全为KHCO3,2.2gKHCO3中所含质子物质的量为![]() 50=1.1mol,若2.2g全为Mg3N2,2.2gMg3N2中所含质子物质的量为
50=1.1mol,若2.2g全为Mg3N2,2.2gMg3N2中所含质子物质的量为![]() 50=1.1mol,KHCO3与Mg3N2以任意比混合,2.2gKHCO3与Mg3N2的混合物中所含质子物质的量均为1.1mol,B项正确;C项,NaHSO4在熔融状态的电离方程式为NaHSO4=Na++HSO4-,NaHSO4固体在熔融状态下不含SO42-,C项错误;D项,25℃pH=12的溶液中c(OH-)=0.01mol/L,1LpH=12的Na2CO3溶液中n(OH-)=0.01mol,Na2CO3溶液中的OH-主要来自CO32-的微弱水解,溶液中未水解的CO32-远大于0.01mol,溶液中所含Na+远大于0.02mol,D项错误;答案选B。
50=1.1mol,KHCO3与Mg3N2以任意比混合,2.2gKHCO3与Mg3N2的混合物中所含质子物质的量均为1.1mol,B项正确;C项,NaHSO4在熔融状态的电离方程式为NaHSO4=Na++HSO4-,NaHSO4固体在熔融状态下不含SO42-,C项错误;D项,25℃pH=12的溶液中c(OH-)=0.01mol/L,1LpH=12的Na2CO3溶液中n(OH-)=0.01mol,Na2CO3溶液中的OH-主要来自CO32-的微弱水解,溶液中未水解的CO32-远大于0.01mol,溶液中所含Na+远大于0.02mol,D项错误;答案选B。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B. 配制一定浓度的FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C. 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4 mol·L-1
D. 浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化不属于取代反应的是( )
A.光照射甲烷与氯气的混合气体
B.乙烯通入溴的四氯化碳溶液中
C.乙酸与乙醇在浓硫酸加热条件下生成乙酸乙酯
D.苯与液溴混合后撒入铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是
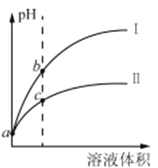
A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式____________________________。
(3)氢氧化铁胶体中微粒直径的范围是______,证明有氢氧化铁胶体生成的实验操作是______________。
(4)取少量制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是_________,这种现象称为胶体的________。
(5)氢氧化铁胶体稳定存在的主要原因是________(填字母,下同)。
A.胶体微粒直径小于1 nm B.胶体微粒带正电荷
C.胶体微粒做布朗运动 D.胶体微粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液的最本质特征是________。
A.Fe(OH)3胶体微粒的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔现象
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为_____________。

(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。T______100 ℃(填“大于”或“小于”),判断理由是____________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com