
����Ŀ����һ���¶��µĺ��������У��Կ��淴Ӧ2SO2(g)+O2(g)![]() 2SO3(g)�����������У���˵����Ӧ�Ѵﵽ��ѧƽ��״̬���ǣ� ��
2SO3(g)�����������У���˵����Ӧ�Ѵﵽ��ѧƽ��״̬���ǣ� ��
�ٵ�λʱ���ڶ���a mol O=O����ͬʱ����2a mol SO3��SO2���ɵ�������SO3�ֽ��������Ȣ������ڵ�ѹǿ���ٱ仯�ܻ����������ʵ������ٱ仯�ݻ�������ƽ����Է����������ٱ仯���������ܶȲ��ٱ仯
A. �ڢۢ�B. �ڢܢ�C. �ۢܢ�D. �٢ڢ�
���𰸡�C
��������
���淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣬�ݴ˷������
�ٵ�λʱ���ڶ���a mol O=O����ͬʱ����2a mol SO3������������Ӧ���ʣ�����ȷ���ﵽƽ��״̬���ʢٴ���SO2���ɵ�������SO3�ֽ�����ʣ���Ϊ�淴Ӧ������ȣ����жϷ�Ӧ�ﵽƽ��״̬���ʢڴ��������ڵ�ѹǿ���ٱ仯��˵���������������ʵ���������ʱ��仯���仯����ƽ��״̬���ʢ���ȷ��������Ӧ�ǻ�����������ʵ�����С�ķ��������������ʵ������ٱ仯����ƽ��״̬���ʢ���ȷ���ݻ����������������䣬�������������ʵ�����ȷ��������������ƽ����Է����������ٱ仯ʱ��˵�����������ʵ���������ʱ��仯���仯����ʱ��ƽ��״̬���ʢ���ȷ������������������������ʼ��һ��������������ܶȲ��ٱ仯����ȷ����ƽ��״̬���ʢ��ۢܢ���ȷ���ʴ�ΪC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���ʼ��仯�����ںܶ���������Ҫ��;�������ͭ����������ߵ��£���ˮ������ͭ������ɱ�����ȡ�
��1����̬Cu2���ĺ�������Ų�ʽΪ____________��
��2����ѧ��ͨ��X�����Ʋ���мȺ�����λ�����ֺ����������ṹʾ��ͼ�ɼ�ʾ���£�
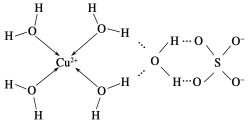
�ٵ����Ļ�ѧʽ����������ʽ��ʾΪ____________��
�ڵ�����SO42-�����幹������Ϊ________��H2O��VSEPRģ������Ϊ____��
��3��������ͭ��Һ�м��������ˮ��������[Cu(NH3)4]2�������ӡ���֪NF3��NH3�Ŀռ乹�Ͷ��������Σ���NF3������Cu2���γ������ӣ���ԭ����______________________��
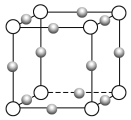
��4��Cu3N�γɵľ���ṹ����ͼ��ʾ��N3������λ����______���辧���߳�Ϊa cm���ܶ�Ϊb g/cm3�����ӵ������ɱ�ʾΪ______________(�ú�a��b��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����������ʯβ��(��Ҫ�ɷ�ΪMgO������FeO��Fe2O3��Al2O3��)�Ʊ������Ȼ�þ����(MgCl2��6H2O)��ʵ���������£�

��֪���ֽ����������γ������������ʱ��pH���±�

�ش��������⣺
(1)����ȡ�������У��ܼӿ��ȡ���ʵķ�����______________________(��д����)��
(2)����X�ĵ���ʽΪ___________������1�������������Ƶ�һ�ָ�Ч�����߷��ӻ���������ˮ�����仯ѧʽΪ[Fe2(OH)n(SO4)(3-0.5n)]m�������������Ԫ�صĻ��ϼ�Ϊ___________��
(3)����H2O2��Ŀ����___________���������������еġ�H2O2���á� NaClO������Ҳ�ܴﵽͬ��Ŀ�ģ�������Ӧ�����ӷ���ʽΪ_________________________________��
(4)��һϵ�в�������Ҫ���������������ᣬȻ��______________________�����ˡ�ϴ�ӣ����õ��Ȼ�þ���塣
(5)ȷ��ȡ2.000g�Ȼ�þ�����Ʒ��250mL��ƿ�У���ˮ50mLʹ����ȫ�ܽ⣬����100mL���Ի���Һ����������Tָʾ������Һ�Ծƺ�ɫ���ڲ������£���0.5000mol��L��1��EDTA����Һ���еζ����䷴Ӧԭ��ΪMg2++Y4��=MgY2�����ζ��յ�ʱ����EDTA����Һ�����19.00mL��
�����Ʒ��MgCl2��6H2O����������Ϊ___________(�������3λ��Ч����)��
�����еζ������ᵼ�²������ƫ�ߵ���___________(����ĸ)��
a.��ƿϴ�Ӻ�û�и��� b.�ζ�ʱ��ƿ����Һ�彦��
c�ζ��յ�ʱ���Ӷ��� d�ζ��ܵζ�ǰ�����ݣ��ζ���������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��Ȳ�ĵ���ʽ__________________��
(2)![]() ����ʽ��_________________��
����ʽ��_________________��
(3)![]() �䱽���ϵ�һ�ȴ�����______��
�䱽���ϵ�һ�ȴ�����______��
(4)�ṹ��ʽΪ![]() ��������Ϊ___________________��
��������Ϊ___________________��
(5) 4��4��5��������2����Ȳ(д���ṹ��ʽ)��____________����
(6)�ṹ��ʽΪ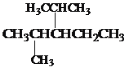 ����������Ϊ��____________________����
������������____________________����
(7)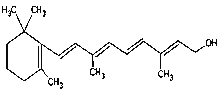 1mol����������_______molH2.
1mol����������_______molH2.
(8)���𱽣��⻯����Һ����������Һ����ϩ�����Ȼ�̼ʱ��ֻ����һ���Լ������Լ���_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϡ����μӵ�ʢ��̼��Ƶ�U�ι��У��ɹ۲쵽U�ι��е���֬����ȼ�ա�
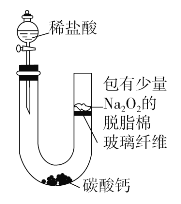
(1)ϡ������̼��Ʒ�Ӧ�����ӷ���ʽ��__________________________
(2)����֬��ȼ�տ����Ƴ�Na2O2��CO2��Ӧ�Ľ�����a.________________��b.________________��
(3)Na2O2��CO2��Ӧ�Ļ�ѧ����ʽ��_________________________����ԭ����________����������________��(�ѧʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һδ֪Ũ�ȵ����ᣬijͬѧ��ʵ�����н���ʵ��ⶨ�����Ũ�ȡ������������գ�
����100mL0.10molL-1NaOH����Һ������������ƽ����___g���������ƹ��塣
ȡ20.00mL�������������ƿ�У����μ� 2~3�η�̪��ָʾ���������Ƶı� NaOH��Һ���еζ����ظ������ζ����� 2~3�Σ���¼�������£�
�ζ����� | ������������/mL | 0.10 mol/L NaOH ��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
��һ�� | 20.00 | 2.00 | 28.15 |
�ڶ��� | 20.00 | 1.50 | 29.50 |
������ | 20.00 | 0.20 | 26.55 |
�ٸ�ʵ��ζ��ﵽ�յ�ı�־��_________
�ڸ����������ݣ��ɼ�����������Ũ��ԼΪ______����������λ��Ч���֣�
��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ���_______����˫ѡ��
A �ζ��յ����ʱ���Ӷ��� B ��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������ϴ
C ��ƿˮϴ��δ���� D ��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
E ����NaOH ����ʱ����������KOH����
����������ʵ�����Ƶ�0.10molL��1NaOH��Һ�ζ�δ֪Ũ�ȵ�CHCOOH��Һ����Ӧǡ����ȫʱ��������������ȷ����_____
A ��Һ�����ԣ���ѡ�ü��Ȼ��̪��ָʾ��
B ��Һ�����ԣ�ֻ��ѡ��ʯ����ָʾ��
C ��Һ�ʼ��ԣ���ѡ�ü��Ȼ��̪��ָʾ��
D ��Һ�ʼ��ԣ�ֻ��ѡ�÷�̪��ָʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮú������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̼���Ƶã�C (s) +H2O(g)![]() CO(g) +H2(g) ��H��+131.3kJmol��1
CO(g) +H2(g) ��H��+131.3kJmol��1
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=___����ij�¶��£�Kֵ�Ĵ�СΪ0.5����ʱ�����Ϊ1L���ܱ������м���1mol H2O(g)������C(s)��H2O(g)��ƽ��ת����Ϊ___
��2�����ڸ÷�Ӧ��һ���������ƽ����ϵ��H2�İٷֺ��������ܼӿ컯ѧ��Ӧ���ʵĴ�ʩ��____��
a�������¶� b������ˮ������Ũ�� c��������� d������ѹǿ
��3��������Ӧ�ﵽƽ���������ϵ�в���C(s)��ƽ��_____����������COȫ�����ߣ�ƽ��___����������ѡ�������������������������������ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ�ʾH2(g)+ I2(g)![]() 2HI(g)�Ѿ��ﵽƽ��״̬�ı�־�ǣ� ��
2HI(g)�Ѿ��ﵽƽ��״̬�ı�־�ǣ� ��
��c(H2)=c(I2)=c(HI)ʱ
��c(H2)��c(I2)��c(HI)=1��1��2ʱ
��c(H2)��c(I2)��c(HI)������ʱ����ı�
�ܵ�λʱ��������nmolH2��ͬʱ����2nmolHI
�ݵ�λʱ��������nmolH2��ͬʱ����nmolI2
��Ӧ��v(H2)=v(I2)=1/2v(HI)
��һ��H-H�����ѵ�ͬʱ������H-I������
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯
����һ������������ƽ����Է����������ٱ仯
A.�ۢܢߢ��B.�ۢܢߢ�C.�ڢۢܢߢ�D.�ڢۢܢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������ͼװ����ȡ�����Ȼ�������֪�Ȼ����۷е㶼�ܵ�(178������),����ˮ�⡣����˵������ȫ��ȷ��һ����
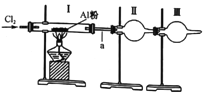
�������к���ˮ�������Ȼ����ͨ��ʢ�п����Ƶĸ���ܳ�ȥ
��װ��I�г�������ɫ������ټ���ʢ��A���۵�Ӳ�ʲ�����
��װ��II���ռ�װ�ã������ռ��Ȼ���
��װ��III��ʢ�ż�ʯ��Ҳ��ʢ����ˮ�Ȼ��ƣ����ߵ�������ͬ
��a��ʹ�ýϴֵĵ�����ʵ��ʱ����ȫ
A. �٢� B. �ڢۢ� C. �٢� D. �ۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com