
【题目】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水合硫酸铜可用作杀菌剂等。
(1)基态Cu2+的核外电子排布式为____________。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
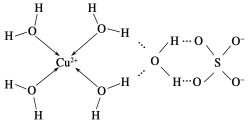
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42-的立体构型名称为________,H2O的VSEPR模型名称为____。
(3)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________。
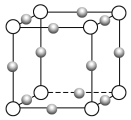
(4)Cu3N形成的晶体结构如下图所示,N3-的配位数是______。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为______________(用含a、b的式子表示)。
【答案】[Ar]3d9 [Cu(H2O)4]SO4·H2O 正四面体形 正四面体形 F的电负性比N大,N—F成键电子对偏向F原子,使得氮原子上的孤对电子难与Cu2+形成配离子 6 ![]()
![]()
【解析】
(1)Cu元素是29号元素,其原子核外有29个电子,Cu原子失去2个电子生成Cu2+,根据构造原理书写铜离子核外电子排布式;
(2)①根据图象知铜离子的配位数是4,另外一个水分子是结晶水分子;
②根据价层电子对互斥理论确定离子空间构型及原子杂化方式;
(3)NF3中N﹣F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(4)该晶胞中小球个数=12×![]() =3,白色球个数=8×
=3,白色球个数=8×![]() =1,根据其化学式知,小球表示Cu+、白色球表示N3﹣,N3﹣的配位数为6;该晶胞的体积=a3cm3,密度b=
=1,根据其化学式知,小球表示Cu+、白色球表示N3﹣,N3﹣的配位数为6;该晶胞的体积=a3cm3,密度b=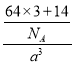 ,据此计算NA。
,据此计算NA。
(1)Cu元素是29号元素,其原子核外有29个电子,Cu原子失去2个电子生成Cu2+,根据构造原理知铜离子核外电子排布式为[Ar]3d9;
(2)①根据图象知铜离子的配位数是4,另外一个水分子是结晶水分子,则胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4H2O;
②胆矾中SO42﹣的价层电子对个数=4+1/2×(6+2﹣4×2)=4,所以其空间构型正四面体结构;H2O中O原子价层电子对个数=2+1/2×(6﹣2×1)=4,所以H2O的VSEPR模型为四面体;
(3)F的电负性大于N元素,NF3中N﹣F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子;
(4)该晶胞中小球个数=12×![]() =3,白色球个数=8×
=3,白色球个数=8×![]() =1,根据其化学式知,小球表示Cu+、白色球表示N3﹣,N3﹣的配位数为6;该晶胞的体积=a3cm3,密度b=
=1,根据其化学式知,小球表示Cu+、白色球表示N3﹣,N3﹣的配位数为6;该晶胞的体积=a3cm3,密度b=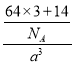 ,则NA=
,则NA=![]() 。
。


科目:高中化学 来源: 题型:
【题目】(题文)查阅资料得酸性大小:H2CO3>苯酚>HCO3-。若用如图装置(部分夹持仪器省略)进行探究碳酸和苯酚的酸性强弱实验,下列叙述不正确的是( )
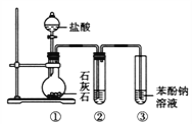
A. ②中试剂为饱和NaHCO3溶液
B. 打开分液漏斗旋塞,①产生无色气泡,③出现白色浑浊
C. 苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
D. ③中发生反应的化学方程式是2![]() +CO2 +H2O→
+CO2 +H2O→![]() +Na2CO3
+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.足量铁屑溶于稀硝酸: Fe+2H+= 2Fe2++ H2↑
B.氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O
C.NO2通入水中:3NO2 + H2O = 2H+ + 2NO3- + NO
D.实验室用加热铵盐和碱的固体混合物的方法制取氨:OH- + NH4+ ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的价电子排布式为nsnnpn |
Y | Y的负一价离子的电子层结构都与氩相同 |
Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
W | W原子共有6个价电子,其中五个价电子位于第三能层d轨道 |
(1)Z在元素周期表中的位置 _______________________,Z的氢化物空间构型是________
(2)在H—Y、H—Z两种共价键中,键的极性较强的是____________(用相应的元素符号表示该共价键)。
(3)XZ2分子中X以________方式杂化。
(4)写出W元素的原子核外电子排布式___________________________________。
(5)Y元素和Na形成晶体的部分结构可用下图中的_________来表示(填序号)。
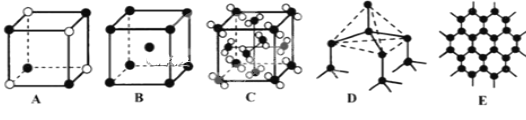
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式如图所示,以下关于维生素B1的说法正确的是
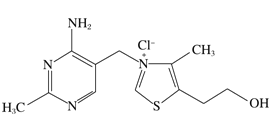
A. 只含σ键和π键
B. 既有共价键又有离子键
C. 该物质的熔点可能高于CsCl
D. 维生素B1晶体溶于水的过程中克服的微粒间作用力只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应使用催化剂后,其反应过程中能量变化如图所示。下列说法错误的是
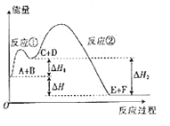
A. △H=△H1-△H2
B. 该反应的总反应为放热反应
C. 使用催化剂,不能改变反应进行的方向
D. 反应①是吸热反应,反应②是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如下图所示,请回答下列问题;
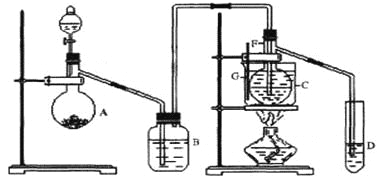
(1)实验开始时,仪器A中盛放电石,B中应装_________,其作用是___________________。
(2)仪器D中盛放水,其作用是_________________________________________________。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称____________________。将HgO加放F中的操作方法是__________________________________。
(4)装置图中,加热F的方法叫___________,所选用温度计G的量程表示正确的是______。(填代号)。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃
D.50℃~100℃ E. 0℃~360℃
(5)检验乙醛已制出的操作及现象______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是

A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+) > c(OH-) > c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,对可逆反应2SO2(g)+O2(g)![]() 2SO3(g),下列叙述中,能说明反应已达到化学平衡状态的是( )
2SO3(g),下列叙述中,能说明反应已达到化学平衡状态的是( )
①单位时间内断裂a mol O=O键,同时生成2a mol SO3②SO2生成的速率与SO3分解的速率相等③容器内的压强不再变化④混合气体的物质的量不再变化⑤混合气体的平均相对分子质量不再变化⑥混合气体的密度不再变化
A. ②③④B. ②④⑥C. ③④⑤D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com