
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的价电子排布式为nsnnpn |
Y | Y的负一价离子的电子层结构都与氩相同 |
Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
W | W原子共有6个价电子,其中五个价电子位于第三能层d轨道 |
(1)Z在元素周期表中的位置 _______________________,Z的氢化物空间构型是________
(2)在H—Y、H—Z两种共价键中,键的极性较强的是____________(用相应的元素符号表示该共价键)。
(3)XZ2分子中X以________方式杂化。
(4)写出W元素的原子核外电子排布式___________________________________。
(5)Y元素和Na形成晶体的部分结构可用下图中的_________来表示(填序号)。
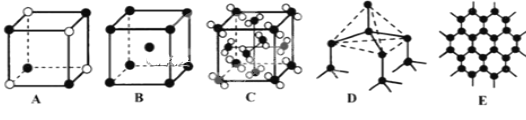
【答案】第三周期ⅥA族 V型 H—Cl sp 1s22s22p63s23p63d54s1 A
【解析】
s能级最多容纳2个电子,根据构造原理,推出X为C,Y的负一价离子的电子层结构都与氩相同,即Y为Cl,Z的单质是淡黄色固体,常在火山口附近沉积,则Z为S,W原子共有6个价电子,其中5个价电子位于第三能层d轨道,价电子排布式为3d54s1,即W为Cr;
s能级最多容纳2个电子,根据构造原理,推出X为C,Y的负一价离子的电子层结构都与氩相同,即Y为Cl,Z的单质是淡黄色固体,常在火山口附近沉积,则Z为S,W原子共有6个价电子,其中5个价电子位于第三能层d轨道,价电子排布式为3d54s1,即W为Cr;
(1)根据上述分析,S位于第三周期VIA族;Z的氢化物为H2S,S杂化类型为sp3,即H2S空间构型为V型;
(2)Cl的电负性强于S,因此H-Cl极性强于H-S;
(3)XZ2为CS2,结构式为S=C=S,C的杂化类型为sp;
(4)W为Cr,其核外电子排布式为1s22s22p63s23p63d54s1;
(5)Cl和Na形成的化合物是NaCl,NaCl属于离子化合物。A、黑球位于顶点,属于该晶胞的个数为4×1/8=1/2,白球位于顶点,属于该晶胞的个数为4×1/8=1/2,原子个数比为1:1,即化学式为NaCl,故A符合题意;
B、该晶体为单质晶体,故B不符合题意;
C、NaCl为离子化合物,是由Na+和Cl-组成,不存在“NaCl”分子,故C不符合题意;
D、该晶体为原子晶体的结构,故D不符合题意;
E、该结构为石墨结构,故E不符合题意。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。请回答:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应, 生成无毒物质,减少汽车尾气污染。
已知:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2= -221.0 kJ·mol-1
C(s)+O2(g)=CO2(g) △H3= -393.5 kJ·mol-1
计算尾气转化反应 2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=_____。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) △H= -11.63 kJ·mol-1。反应在2L 密闭容器中进行,在其它条件相同时,使用不同的催化剂 A、B、C,产生 N2 的物质的量随时间变化如图 1 所示。
5N2(g)+6H2O(g) △H= -11.63 kJ·mol-1。反应在2L 密闭容器中进行,在其它条件相同时,使用不同的催化剂 A、B、C,产生 N2 的物质的量随时间变化如图 1 所示。

图1 图2
①下列有关说法正确的是__________________________________。
A. 反应在任何温度下均可自发进行
B. 50 s 在催化剂A 作用下,平均反应速率v(N2)=2.5×10-2mol·L-1·s-1
C. 用催化剂C 达到平衡时,N2 产率最小
D. 分离出反应体系中的H2O(g)有利于氮氧化物的脱除
E. 相同条件下,若使用催化剂 B,使逆反应速率加快 100 倍,使用催化剂 C,使正反应速率加快 65 倍,则应该选用催化剂 B
②在催化剂A 的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图 2 所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(假设催化剂活性不受影响),写出脱氮率随温度变化的原因__________________________。
③其他条件相同时,请在图 2 中补充在催化剂B 作用下脱氮率随温度变化的曲线。__________________________________________________________
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的 NO,装置如图所示
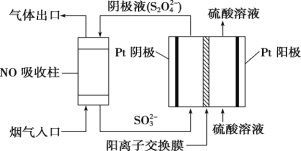
① 阴极区的电极反应式为___________________________________________ 。
② 通电时,当电路中转移 0.2mol e-,可吸收的 NO 在标准状况下的体积为 896mL。则 NO转化后的产物为_____________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.加入少量水,水的电离平衡向电离方向移动
B.再通入少量氯气,Cl2+H2O![]() HCl+HCIO,平衡向正方向移动,c(Cl2)减少
HCl+HCIO,平衡向正方向移动,c(Cl2)减少
C.通入少量SO2,溶液漂白性增强
D.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是
A. 沸点:新戊烷>2,2-二甲基戊烷>丙烷
B. 密度:CCl4>H2O>甲苯
C. 等质量的物质燃烧耗O2量:乙烷>乙烯>乙炔>甲烷
D. 等物质的量物质燃烧耗O2量:环己烷>苯>苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水合硫酸铜可用作杀菌剂等。
(1)基态Cu2+的核外电子排布式为____________。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
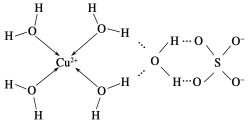
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42-的立体构型名称为________,H2O的VSEPR模型名称为____。
(3)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________。
(4)Cu3N形成的晶体结构如下图所示,N3-的配位数是______。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为______________(用含a、b的式子表示)。
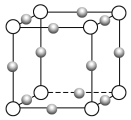
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲班学生做完实验室制备氧气和还原金属氧化物的实验后,剩余物质倒入同一废液缸里。乙班课外兴趣小组同学进行了如图所示的探究。请回答:
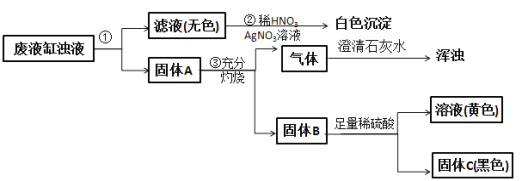
(1)步骤①的操作名称是___________,所用到的玻璃仪器有漏斗、玻璃棒和___________。
(2)由步骤②实验现象推知,甲班同学制取氧气所用的固体反应物是___________(写化学式)。
(3)由步骤④所得溶液加入氢氧化钠可得红棕色沉淀,该反应的化学方程式为______________________。
(4)由步骤③产生的气体判断固体A中一定含有___________(写名称);综合步骤③④现象推理,固体A中还可能含有的物质是______________________(写至少两种物质的化学式)。
(5)根据上述实验和分析判断固体C是___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙炔的电子式__________________。
(2)![]() 分子式:_________________。
分子式:_________________。
(3)![]() 其苯环上的一氯代物有______种
其苯环上的一氯代物有______种
(4)结构简式为![]() 此烃名称为___________________。
此烃名称为___________________。
(5) 4,4,5﹣三甲基﹣2﹣己炔(写出结构简式) ____________。
(6)结构简式为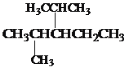 的烃可命名为:____________________。
的烃可命名为:____________________。
(7)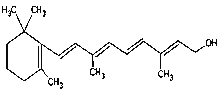 1mol该物质消耗_______molH2.
1mol该物质消耗_______molH2.
(8)鉴别苯,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是_________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com