
【题目】实验室从含碘废液(除H2O外,还含有CCl4、I2、I﹣)中回收碘,其实验过程如图1:
(1)向含碘废液中加入稍过量的Na2SO3溶液时发生的离子方程式为;该操作的目的是 .
(2)操作X应在(填写仪器名称图2)中进行,简述得到溶液B的过程:将混合溶液静置后,
(3)在三颈瓶中将溶液B用盐酸调至pH约为2,缓慢通入Cl2 , 在40C左右反应(实验装置如右图所示).实验控制在较低温度下进行的原因是;锥形瓶里盛放的溶液为(填溶质的化学式).
(4)某含碘废水(pH约为4)中一定存在I2 , 可能存在I﹣或IO3﹣ . 可以使用(填溶质的化学式,下同)溶液检验可能存在的I﹣或溶液检验可能存在的IO3﹣ . 在检验该含碘废水中是否含有I﹣或IO3﹣前必需要进行的操作是(填序号).
a.取适量含碘废水用CCl4多次萃取、分液
b.用NaOH溶液将溶液调节到中性
c.向溶液中滴入少量淀粉溶液.
【答案】
(1)SO32﹣+I2+H2O=2I﹣+2H++SO42﹣;使CCl4中的碘进入水层
(2)分液漏斗;将混合溶液静置后,打开分液漏斗上部盖子,旋开活塞,放出下部液体.待下部液体完全分离后,关闭活塞,从上部倒出剩余液体
(3)使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH
(4)FeCl3;Na2SO3;ac
【解析】解:(1.)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘,离子反应方程式为SO32﹣+I2+H2O=2I﹣+2H++SO42﹣;碘不容易溶于水,但碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子,所以答案是:SO32﹣+I2+H2O=2I﹣+2H++SO42﹣;使四氯化碳中的碘进入水层;
(2.)四氯化碳属于有机物、水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法,实验仪器为分液漏斗,得到溶液的操作为:将混合溶液静置后,打开分液漏斗上部盖子,旋开活塞,放出下部液体.待下部液体完全分离后,关闭活塞,从上部倒出剩余液体;所以答案是:分液漏斗;将混合溶液静置后,打开分液漏斗上部盖子,旋开活塞,放出下部液体.待下部液体完全分离后,关闭活塞,从上部倒出剩余液体;
(3.)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,所以答案是:使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH溶液;
(4.)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:
从水层取少量溶液,加入1﹣2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I﹣+2Fe3+=2Fe2++I2 , 若溶液变蓝色,说明废水中含有I﹣ , 否则不含I﹣;
另从水层取少量溶液,加入1﹣2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32﹣+2 IO3﹣+2H+=I2+5SO42﹣+H2O,若溶液变蓝色,说明废水中含有IO3﹣ , 否则不含IO3﹣ , 在检验该含碘废水中是否含有I﹣或IO3﹣前必需要进行的操作是取适量含碘废水用CCl4多次萃取、分液,向溶液中滴入少量淀粉溶液依据是否变蓝验证离子的存在;所以答案是:FeCl3 , Na2SO3 , ac;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )
A.甲:Na、X:O2
B.甲:NaOH溶液、X:CO2溶液
C.甲:C、X:O2
D.甲:AlCl3溶液、X:NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):

请回答下列问题:
(1)A的化学名称是_____________;
(2)B和A反应生成C的化学方程式为_______________________,
该反应的类型为_____________;
(3)D的结构简式为_____________;
(4)F的结构简式为_____________;
(5)D的同分异构体的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)xC(g),符合如图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强).在图中Y轴是指( ) 
①反应物A的转化率
②平衡混合气中物质B的百分含量
③平衡混合气的密度
④平衡混合气的平均摩尔质量.
A.①③
B.②③
C.③④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( ) 
A.a<0,T<250
B.250℃时,0~10min内:v(H2)=0.015mol/(Lmin)
C.CO的平衡转化率在250℃时比T℃大
D.250℃时,起始时向容器中改充1molCH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4 , 用“C3”表示C3H6O3):
Ⅰ、H2O(l)═2H+(aq)+ ![]() O2(g)+2e﹣△H=+284kJ/mol
O2(g)+2e﹣△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e﹣═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=﹣1200kJ/mol
(1)写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式 .
(2)降低大气中CO2的含量及有效地开发利用CO2 , 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(Lmin);
②氢气的转化率=;
③该反应的平衡常数表达式为K=;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1 , 然后向容器中再加入一定量H2 , 待反应再一次达到平衡后,H2的物质的量浓度为c2 . 则c12的关系(填>、<、=).
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
①通入氧气一极的电极反应式为;
②随着电池不断放电,电解质溶液的pH(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.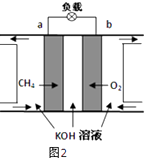
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2O![]() PbO2+Pb+2H2SO4下列对铅蓄电池的说法错误的是( )
PbO2+Pb+2H2SO4下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO42-===PbSO4
D.工作时电解质的密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.图为RFC工作原理示意图,有关说法正确的是( ) 
A.当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e﹣=2H2↑+4OH﹣
C.d极上发生的电极反应是:O2+4H++4e﹣=2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中叙述正确的是( )
A. 萃取操作必须在分液漏斗中进行
B. 振荡试管中液体时,手拿住试管,用手腕甩动
C. 用剩的药品应收集起来放回原试剂瓶中
D. 称量物质时先取小砝码,再依次取较大的砝码
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com