
| A. | 影响化学反应速率的因素与化学物质本身无关 | |
| B. | 反应物颗粒越小,其表面积就越小,化学反应速率就越慢 | |
| C. | 加入催化剂一定能够加快化学反应速率 | |
| D. | 增大反应物的浓度和升高反应物的温度都可以加快化学反应速率 |
分析 影响化学反应的主要因素为物质的本身性质,一般来说,温度越高、压强、浓度越大、固体表面积越大等,都可增大反应速率,加入催化剂,可增大活化分子百分数,可增大反应速率,以此解答该题.
解答 解:A.影响化学反应的主要因素为物质的本身性质,故A错误;
B.反应物颗粒越小,其表面积就越大,反应速率越大,故B错误;
C.如为负催化剂,则减小反应速率,故C错误;
D.增大反应物浓度,可增大单位体积活化分子数目,升高温度,可增大活化分子百分数,可增大反应速率,故D正确.
故选D.
点评 本题考查化学反应素的影响因素,侧重于学生的分析能力和基本概念、理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | CuSO4 | C. | Cu(OH)2•6H2O | D. | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
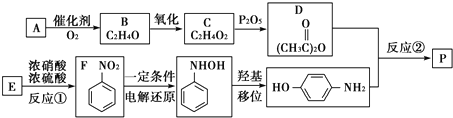
 -NH2中-NH2上的氢原子较活泼.
-NH2中-NH2上的氢原子较活泼. .
.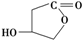 ,W的酸性水解产物的名称为3,4-二羟基丁酸;W不具有的化学性质中是C(填代号).
,W的酸性水解产物的名称为3,4-二羟基丁酸;W不具有的化学性质中是C(填代号). 、
、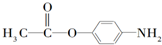 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
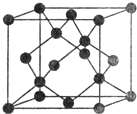 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 元素 | 特征 |
| X | 周期表中,原子半径最小 |
| Y | 常温下,可以形成Y2、Y3型的气体单质 |
| Z | 其原子内层电子与最外层电子数之比为10:1 |
| W | 最高化合价为+6 |
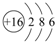 .
.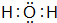 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com