
(12分)现有常温下的0.1 mol·l-1纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 (填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知常温下0.1 mol·L-1Na2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。
答: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是 。(双选,填序号)
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)=0.1 mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下,pH均为13的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比= 。
(5)25℃下,CuSO4溶液中的c(Cu2+)为0.020 mol/l,如果要生成沉淀,应调整溶液的pH大于 。
(25℃下,Cu(OH)2 的 Ksp=2.0×10-20)
(1)CO32- + H2O HCO3- + OH- BaCl2或CaCl2
HCO3- + OH- BaCl2或CaCl2
(2)测0.1 mol·L-1 Na2CO3溶液pH,pH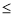 12 (3)D、E (4)1012 (5)5
12 (3)D、E (4)1012 (5)5
【解析】
试题分析:(1)碳酸钠溶液中碳酸根离子水解的方程式为CO32- + H2O HCO3- + OH-;Ba2+或Ca2+与结合生成碳酸钡或碳酸钙沉淀,使水解平衡逆向移动,故可加入BaCl2或CaCl2;(2)发生水解的CO32—不超过其总量的10%,所以c(OH-)
HCO3- + OH-;Ba2+或Ca2+与结合生成碳酸钡或碳酸钙沉淀,使水解平衡逆向移动,故可加入BaCl2或CaCl2;(2)发生水解的CO32—不超过其总量的10%,所以c(OH-) 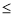 10-2,PH
10-2,PH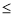 12,可以用测PH的方法验证;(3)因为CO32-水解,所以c(Na+)>2c(CO32—);HCO3—通过第一步水解得到、H2CO3通过第二步水解得到,所以c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)正确;根据质子守恒,c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)正确;根据物料守恒c(CO32—)+c(HCO3—) +c(H2CO3)=0.1 mol·L-1,故c(CO32—)+c(HCO3—)=0.1 mol·L-1错误;根据电荷守恒,c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+2c(CO32—),所以E错误。(4)pH均为13的Na2CO3水电离产生的c(OH—)= 0.1 mol·L-1、pH为13的NaOH溶液中水电离产生的c(OH—)=
12,可以用测PH的方法验证;(3)因为CO32-水解,所以c(Na+)>2c(CO32—);HCO3—通过第一步水解得到、H2CO3通过第二步水解得到,所以c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)正确;根据质子守恒,c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)正确;根据物料守恒c(CO32—)+c(HCO3—) +c(H2CO3)=0.1 mol·L-1,故c(CO32—)+c(HCO3—)=0.1 mol·L-1错误;根据电荷守恒,c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+2c(CO32—),所以E错误。(4)pH均为13的Na2CO3水电离产生的c(OH—)= 0.1 mol·L-1、pH为13的NaOH溶液中水电离产生的c(OH—)=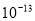 mol·L-1;(5)
mol·L-1;(5)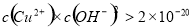 ,c(OH-)>
,c(OH-)>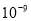 mol·L-1,pH大于5。
mol·L-1,pH大于5。
考点:本题考查化水溶液。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.金属单质和盐溶液的反应不一定是置换反应
B.质量数相等的不同核素,一定属于不同种元素
C.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则原溶液中一定有SO42-
D.Al2O3既能与强酸反应,又能与强碱反应,Al2O3属于两性氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
对于反应2SO2(g)+O2(g) 2SO3(g)能增大逆反应速率的措施是
A.增大O2的量 B.移去部分SO3 C.增大容器容积 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
在下列实验过程中,出现的“异常”现象的解释,不正确的是
A.金属钠投入到硫酸铜溶液中,生成黑色沉淀物,是因为氢氧化铜的生成
B.过氧化钠加入到含有酚酞的水中,溶液变红再变无色,可能有强氧化性物质生成
C.过量的二氧化碳通入澄清石灰水中,溶液变浑浊再变澄清,说明最终生成可以溶于水的盐
D.在氯化亚铁的溶液中,滴加氢氧化钠溶液 ,先有白色沉淀,随后变灰绿色再变红褐色,说明氢氧化亚铁易被空气中的氧气氧化
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关钠元素等的叙述中,错误的是
A.单质钠熔点低于100℃
B.钠元素只能以化合态存在于自然界
C.Na与Na+都具有强的还原性
D.金属钠具有好的导电性,但日常中不用作导线
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:选择题
FeCl3水解平衡为:Fe3++3H2O Fe(OH)3+3H+;若要使c(Fe3+)降低,且pH值增大的方法是
Fe(OH)3+3H+;若要使c(Fe3+)降低,且pH值增大的方法是
A.降低温度 B.通入少量HCl气体
C.加入少量Fe粉 D.加入适量蒸馏水
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:选择题
某无色溶液中粒子能大量共存,通入CO2后仍能大量共存的一组是
A.K+、SO42-、Br-、SiO32- B.H+、Fe2+、Cl- 、NH4+
C.Na+、Ba2+、NO3-、Cl- D.Na+、Ag+、NH3H2O、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广雅等四校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.KSp[MgF2]>KSp[Mg(OH)2],不能实现Mg(OH)2转化为MgF2。
B.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高一上学期期中考试化学卷(解析版) 题型:填空题
(6*1分)某溶液中含有SO42-、CO32-、Cl-三种阴离子。如果每次只检验一种离子,要↑
(1)先检验CO32-,加入 试剂(或溶液),反应的离子方程式为 ;
(2)然后检验SO42,加入 试剂(或溶液),反应的离子方程式为 ;
(3)最后检验Cl-,加入 试剂(或溶液),反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com