
【题目】从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:

完成下列填空:
(1)乙中含氧官能团的名称为___。
(2)由甲转化为乙需经下列过程:
![]()
其中反应Ⅰ的反应类型为___,反应Ⅱ的化学方程式为___。设计反应Ⅰ、Ⅱ的目的是___。
(3)欲检验乙中的碳碳双键,可选用的试剂是___。
a.溴水 b.酸性高锰酸钾溶液 c.溴的CCl4溶液 d.银氨溶液
(4)乙经过氢化、氧化得到丙(![]() ),丙有多种同分异构体,符合苯环上有一个取代基的酯类同分异构体有___种,写出其中能发生银镜反应的同分异构体的结构简式___。
),丙有多种同分异构体,符合苯环上有一个取代基的酯类同分异构体有___种,写出其中能发生银镜反应的同分异构体的结构简式___。
【答案】醛基 加成反应 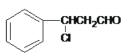 +NaOH
+NaOH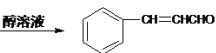 +NaCl+H2O 保护碳碳双键,防止其被氧化 c 6
+NaCl+H2O 保护碳碳双键,防止其被氧化 c 6 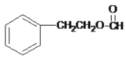 、
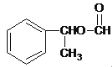
、
【解析】
(1)乙的结构简式为![]() ,含氧官能团为-CHO。
,含氧官能团为-CHO。
(2)甲为![]() ,转化为
,转化为![]() 时,发生的是-CH=CH-与HCl的加成反应,由条件O2/Cu知,发生的是-CH2OH的催化氧化,生成-CHO,然后再消去生成
时,发生的是-CH=CH-与HCl的加成反应,由条件O2/Cu知,发生的是-CH2OH的催化氧化,生成-CHO,然后再消去生成![]() 。
。
(3)a.溴水既能氧化醛基,又能与碳碳双键加成;
b.酸性高锰酸钾溶液,能将醛基和碳碳双键氧化;
c.溴的CCl4溶液,只能与碳碳双键发生加成反应;
d.银氨溶液,只能与醛基发生氧化反应。
(4)![]() ),符合苯环上有一个取代基的酯类同分异构体为苯环上连有:
),符合苯环上有一个取代基的酯类同分异构体为苯环上连有:
HCOOCH2CH2-、HCOOCH(CH3)-、CH3COOCH2-、CH3CH2COO-、-COOCH2CH3、-CH2COOCH3。其中能发生银镜反应的同分异构体的结构简式中,必含有醛基。
(1)乙的结构简式为![]() ,含氧官能团名称为醛基。答案为:醛基;
,含氧官能团名称为醛基。答案为:醛基;
(2)甲为![]() ,转化为
,转化为![]() 时,发生的是-CH=CH-与HCl的加成反应,由条件O2/Cu知,发生的是-CH2OH的催化氧化,生成-CHO,然后再消去生成
时,发生的是-CH=CH-与HCl的加成反应,由条件O2/Cu知,发生的是-CH2OH的催化氧化,生成-CHO,然后再消去生成![]() 。其中反应Ⅰ的反应类型为加成反应,反应Ⅱ的化学方程式为
。其中反应Ⅰ的反应类型为加成反应,反应Ⅱ的化学方程式为![]() +NaOH
+NaOH![]() +NaCl+H2O。甲含碳碳双键,乙也含碳碳双键,设计反应Ⅰ、Ⅱ的目的,是为了防止碳碳双键被氧化,也就是为了保护碳碳双键,防止其被氧化。答案为:加成反应;
+NaCl+H2O。甲含碳碳双键,乙也含碳碳双键,设计反应Ⅰ、Ⅱ的目的,是为了防止碳碳双键被氧化,也就是为了保护碳碳双键,防止其被氧化。答案为:加成反应;![]() +NaOH
+NaOH![]() +NaCl+H2O;保护碳碳双键,防止其被氧化;
+NaCl+H2O;保护碳碳双键,防止其被氧化;
(3)a.溴水既能氧化醛基,又能与碳碳双键加成,a不合题意;
b.酸性高锰酸钾溶液,能将醛基和碳碳双键氧化,b不合题意;
c.溴的CCl4溶液,只能与碳碳双键发生加成反应,c符合题意;
d.银氨溶液,只能与醛基发生氧化反应,d不合题意;故选c。答案为:c;
(4)![]() ),符合苯环上有一个取代基的酯类同分异构体为苯环上连有:
),符合苯环上有一个取代基的酯类同分异构体为苯环上连有:
HCOOCH2CH2-、HCOOCH(CH3)-、CH3COOCH2-、CH3CH2COO-、-COOCH2CH3、-CH2COOCH3,共6种。其中能发生银镜反应的同分异构体的结构简式为 ![]() 、
、![]() 。答案为:6;
。答案为:6;![]() 、
、![]() 。
。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.测定中和热时,大小两烧杯间填满碎纸的作用是固定小烧杯
B.若用0.010mo1·L—1的氢氧化钠标准溶液滴定未知浓度的盐酸时,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,则测定结果偏小
C.在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液
D.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用2a molL﹣1NaOH溶液滴定1.0L2a molL﹣1氢氟酸溶液,得到混合液中HF、F﹣的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
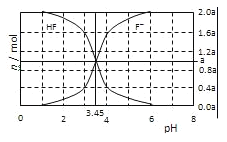
A.pH=3时,溶液中:c(Na+)<c(F﹣)
B.c(F﹣)>c(HF)时,溶液一定呈碱性
C.pH=3.45时,NaOH溶液恰好与HF完全反应
D.pH=4时,溶液中:c(HF)+c(Na+)+ c(H+)-c(OH﹣)<2amolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已达化学平衡的反应:2X(g)+Y(g)![]() 2Z(g),减小压强后,对反应产生的影响是
2Z(g),减小压强后,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动
D.逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】6克含杂质的Na2SO3样品与足量盐酸反应,可生成1.12升气体(S、T、P),气体质量为3克,该样品的组成可能是( )
A.Na2SO3,Na2CO3B.Na2SO3,NaHCO3
C.Na2SO3,NaHCO3,Na2CO3D.Na2SO3,MgCO3,NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为3mol的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,以C表示的平均速率v(C)=0.25molL-1min-1,下列说法正确的是( )
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,以C表示的平均速率v(C)=0.25molL-1min-1,下列说法正确的是( )
A.反应速率v(B)=0.25molL-1min-1
B.该反应方程式中,x=1
C.2min时,A的物质的量为1.5mol
D.2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
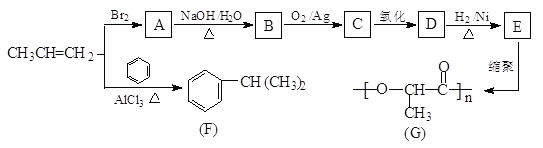
完成下列填空:
(1)F的分子式为_______________,化合物E中所含两个官能团的名称是____、______。
(2)写出反应类型:丙烯直接形成高分子______;A→B____________。
(3)B转化为C的化学方程式为____________。
(4)E的一种同分异构体M具有如下性质:①能发生银镜反应;②1molM与足量的金属钠反应可产生lmolH2,则M的结构简式为____________。
(5)写出由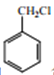 合成
合成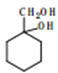 的合成路线________。
的合成路线________。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1) 在上述反应的反应物和生成物中,属于非极性分子的电子式______,属于弱酸的电离方程式______。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是______(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为______。
(4) Na2CO3俗称纯碱,属于______晶体。工业上制取纯碱的原料是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钽是一种过渡金属,钽酸锂(LiTaO3)可用于制作滤波器。一种制备钽酸锂的流程如下:回答下列问题:

(1)LiTaO3中钽的化合价为___。
(2)同体A呈红色,其主要成分是___(写化学式),常见用途有___(填一种即可)。
(3)操作2的名称是___,用来检验溶液B中阴离子的常用试剂是___。
(4)HTaO3是___(填字母)。
a.难溶的强酸 b.可溶的弱酸 c.可溶的强酸 d.难溶的弱酸
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为___。
(6)上述废料中含Ta2O5的质量分数为44.2%,杂质不含Ta元素。现有100kg该废料,按上述流程最多可制备___kgLiTaO3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com