
| A. | 滴加少量1.0mol/L HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| B. | 加水,溶液中c(H+)、c(A-)、c(HA)浓度均减小 | |
| C. | 加入少量NaA固体,平衡向逆反应方向移动,溶液中c(H+)增大 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动,溶液中c(H+)增大 |
分析 A、滴加少量l.0mol/L HCl溶液,溶液中氢离子浓度增大,抑制HA的电离;
B、加入水,促进HA的电离;
C、加入少量NaA固体,溶液中A-浓度增大,抑制电离;
D、加入少量NaOH固体,中和氢离子.
解答 解:A、滴加少量l.0mol/L HCl溶液,溶液中氢离子浓度增大,抑制HA的电离,平衡向左移动,故A错误;
B、加入水,促进HA的电离,c(HA)浓度减小,由于溶液体积增大的程度大于离子浓度增大的程度,所以c(H+)、c(A-)减小,故B正确;
C、加入少量NaA固体,溶液中A-浓度增大,抑制电离,平衡向左移动,溶液中c(H+)减小,故C错误;
D、加入少量NaOH固体,中和氢离子,溶液中c(H+)降低,故D错误;
故选B.
点评 本题考查了弱电解质电离影响因素,题目难度不大,可以借助电离常数与平衡移动原理理解,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素易溶于水 | ||
| C. | 1mol 青蒿素不能发生还原反应 | D. | 青蒿素中碳原子共有三种杂化方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,在某密闭恒压容器中发生反应:2M(g)?N(g)△H=a kJ•mol-1,达到平衡时,N的质量分数[ω(N)]与温度的变化关系如图所示:
一定条件下,在某密闭恒压容器中发生反应:2M(g)?N(g)△H=a kJ•mol-1,达到平衡时,N的质量分数[ω(N)]与温度的变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | O2前面的$\frac{1}{2}$表示参加反应的O2的分子数目 | |
| C. | 燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则H2的燃烧热为285.8 kJ•mol-1 | |
| D. | 1 mol H2和$\frac{1}{2}$ mol O2所具有的总能量大于1mol H2O(g)所具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
 .
.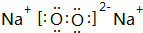 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com