
ЁОЬтФПЁПNa2O2ОпгаЦЏАзадКЭНЯЧПЕФбѕЛЏадЃЌЯТУцЪЧФГЪЕбщаЁзщЩшМЦЕФЙ§бѕЛЏФЦаджЪЬНОПЪЕбщЁЃЛиД№ЯТСаЮЪЬтЃК
ЬНОПNa2O2гыH2ЗДгІЃК
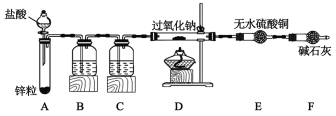
ЃЈ1ЃЉзАжУBжаЫљЪЂЪдМСЕФУћГЦЪЧ___ЃЌЦфзїгУЪЧ___ЃЌЮЊСЫМђЛЏЪЕбщЃЌПЩгУДњЬцBКЭCзАжУ___ЃЈЬюаДзАжУУћГЦКЭзАжУжаЫљЪЂЪдМСЕФУћГЦЃЉЁЃ
ЃЈ2ЃЉзАШывЉЦЗКѓЃЌЕуШМDДІОЦОЋЕЦжЎЧАЕФВйзїЪЧ___ЁЃ
ЃЈ3ЃЉИљОнЯТБэжаЕФаХЯЂЃЌЭъГЩЖдЗДгІЧщПіЕФЬНОПЁЃ
ВНжш | ЯжЯѓ | НсТл |
ЕуШМDДІОЦОЋЕЦ | DжаNa2O2ж№НЅШлЛЏЃЌбеЩЋгЩЂй___ЃЈЬюбеЩЋБфЛЏЃЉЃЌEДІЮоУїЯдЯжЯѓЁЃ | МгШШЬѕМўЯТNa2O2гыH2ЗЂЩњЗДгІЁЃ |
ЗДгІНсЪјКѓЃЌД§DзАжУРфШДКѓЃЌШЁЩйСПDжаЮяжЪгкЪдЙмжаЃЌМгШыЪЪСПЫЎКЭМИЕЮЗгЬЊЁЃ | Ђк___ | Na2O2ЗДгІКѓЮоЪЃгрЃЌNa2O2гыH2ЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКЂл___ЁЃ |
ЬНОПNa2O2гыЫЎЕФЗДгІЃК
ЃЈ4ЃЉгУЭбжЌУоАќЙќNa2O2ЗлФЉЃЌШЛКѓЕЮМИЕЮеєСѓЫЎЃЌЗЂЯжЭбжЌУоШМЩеЦ№РДЃЌЪдЗжЮіЦфжаЕФдвђЃК___ЁЃ
ЃЈ5ЃЉгазЪСЯЯдЪОЃЌNa2O2гыЫЎЗДгІКѓЕФШмвКжагаH2O2ЃЌЩшМЦвЛИіМђЕЅЕФЪЕбщжЄУїH2O2ЕФДцдкЃК___ЁЃ
ЁОД№АИЁПNaOHШмвК Г§ШЅЧтЦјжаЕФHCl ЪЂгаМюЪЏЛвЕФИЩдяЙмЃЈЛђЪЂгаМюЪЏЛвЕФUаЮЙмЃЉ ДђПЊAзАжУжаЕФЗжвКТЉЖЗЛюШћЃЌЭЈШывЛЖЮЪБМфЕФЧтЦјЃЌдкзАжУFЕФФЉЖЫЪеМЏЧтЦјЃЌМьбщЦфДПЖШ ЕЛЦЩЋБфЮЊАзЩЋ ЪдЙмжаЮоЦјХнВњЩњЃЌШмвКБфКь Na2O2+H2![]() 2NaOH Na2O2гыЫЎЗДгІЗХГібѕЦјЃЌЧвИУЗДгІЪЧЗХШШЗДгІЃЌЗХГіЕФШШСПДяЕНСЫЭбжЌУоЕФзХЛ№Еу ШЁЩйСПNa2O2гыЫЎЗДгІКѓЕФШмвКгкЪдЙмжаЃЌМгШыMnO2ЗлФЉЃЌШєЙлВьЕНШмвКжагаЦјХнУАГіЃЌдђжЄУїгаH2O2Дцдк
2NaOH Na2O2гыЫЎЗДгІЗХГібѕЦјЃЌЧвИУЗДгІЪЧЗХШШЗДгІЃЌЗХГіЕФШШСПДяЕНСЫЭбжЌУоЕФзХЛ№Еу ШЁЩйСПNa2O2гыЫЎЗДгІКѓЕФШмвКгкЪдЙмжаЃЌМгШыMnO2ЗлФЉЃЌШєЙлВьЕНШмвКжагаЦјХнУАГіЃЌдђжЄУїгаH2O2Дцдк
ЁОНтЮіЁП
зАжУAЮЊжЦЦјзАжУЃЌзАжУBЪЧГ§дгзАжУЃЌзАжУCЪЧИЩдязАжУЃЛзАгаМюЪЏЛвЕФИЩдяЙмПЩвдЖдзАжУAжажЦЦјЕФЧтЦјЦ№ЕНГ§дгИЩдяЕФзїгУЃЌНсКЯЪЕбщдРэКЭЮяжЪЕФаджЪЗжЮіНтД№ЁЃ
ЃЈ1ЃЉЩњГЩЕФЧтЦјжаЛьгаТШЛЏЧтКЭЫЎеєЦјЃЌBзАжУжаЮЊЧтбѕЛЏФЦШмвКгУгкГ§ШЅТШЛЏЧтЃЌCзАжУжаЮЊХЈСђЫсгУгкГ§ШЅЫЎеєЦјЃЌМюЪЏЛвПЩЭЌЪБЮќЪеТШЛЏЧтКЭЫЎеєЦјЃЌЙЪПЩгУЪЂгаМюЪЏЛвЕФИЩдяЙмДњЬцBКЭCСНзАжУЃЛ
ЃЈ2ЃЉЧтЦјгыПеЦјЛьКЯМгШШЛсЗЂЩњБЌеЈЃЌЙЪЕуШМDДІОЦОЋЕЦЧАЃЌашвЊЯШЭЈШывЛЖЮЪБМфЕФЧтЦјЃЌВЂдкзАжУЕФФЉЖЫЪеМЏХХГіЕФЦјЬхНјаабщДПЃЌД§ХХГіЕФЦјЬхДПОЛСЫЃЌдйЕуШМDДІЕФОЦОЋЕЦЃЛ
ЃЈ3ЃЉИљОнEДІЮоУїЯдЯжЯѓЃЌПЩжЊЙ§бѕЛЏФЦгыЧтЦјЗДгІЮоЫЎЩњГЩЃЌвђДЫВТВтЖўепЗЂЩњСЫЛЏКЯЗДгІЩњГЩСЫNaOHЃЌЙЪЂйЕФЯжЯѓЮЊЕЛЦЩЋБфЮЊАзЩЋЃЛИљОнНсТлNa2O2ЮоЪЃгрЃЌПЩжЊЂкЕФЯжЯѓЮЊЪдЙмжаЮоЦјХнЗХГіЃЌжЛгаШмвКБфКьЃЌзюжеШЗЖЈNa2O2гыЧтЦјЗДгІЕФЗНГЬЪНЮЊЃКNa2O2+H2![]() 2NaOHЃЛ
2NaOHЃЛ
ЃЈ4ЃЉNa2O2гыЫЎЗДгІЛсгабѕЦјЩњГЩЃЌЭбжЌУоФмЙЛШМЩеЃЌЫЕУїNa2O2гыЫЎЗДгІЪЧЗХШШЗДгІЃЌЗХГіЕФШШСПДяЕНСЫЭбжЌУоЕФзХЛ№ЕуЃЛ
ЃЈ5ЃЉЗДгІКѓЕФШмвКжаШчЙћДцдкH2O2ЃЌдђМгШыMnO2ПЩДйЪЙH2O2ЗжНтЃЌШмвКжаЛсгаЦјХнВњЩњЁЃ


 гІгУЬтзївЕБОЯЕСаД№АИ
гІгУЬтзївЕБОЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЭЌбЇЮЊСЫбщжЄФбШмЕФТШЛЏвјдкЫЎжавВДцдкШмНтЦНКтЃЌЩшМЦСЫШчЯТЪЕбщЗНАИЃКЃЈ ЃЉ
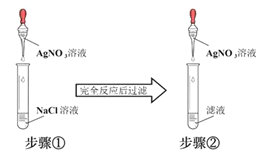
A.ВНжшЂйжагІМгШыЙ§СПЕФAgNO3ШмвК
B.ВНжшЂйжагІЪЙNaClШмвКЙ§СП
C.ВНжшЂкжаЯжЯѓЪЧЮоГСЕэВњЩњ
D.ВНжшЂкжабЁгУЕФAgNO3ШмвКХЈЖШгІаЁгкВНжшЂй
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2ЉєЧЛљвьЖЁЫсввѕЅФмШмгкЫЎЃЌЪЧвЛжжгІгУгкгаЛњКЯГЩКЭвЉЮяжЦдьЕФЛЏЙЄдСЯЁЃ

ЃЈ1ЃЉ2ЉєЧЛљвьЖЁЫсввѕЅЕФЗжзгЪНЮЊ_________ЃЌВЛЭЌЛЏбЇЛЗОГЕФЧтдкКЫДХЙВеёЧтЦзЭМжагаВЛЭЌЕФЮќЪеЗхЃЌдђ2ЉєЧЛљвьЖЁЫсввѕЅга_________ИіЮќЪеЗхЃЛ
ЃЈ2ЃЉЂйЂкЕФЗДгІРраЭЗжБ№ЮЊ_________ЃЌ_________ЃЛ
ЃЈ3ЃЉвбжЊIЮЊфхДњЬўЃЌIЁњBЕФЛЏбЇЗНГЬЪНЮЊ_________ЃЛ
ЃЈ4ЃЉЫѕОлВњЮяFЕФНсЙЙМђЪНЮЊ_________ЃЛ
ЃЈ5ЃЉЯТСаЙигк![]() КЭ
КЭ ЕФЫЕЗЈе§ШЗЕФга_________ЃЈЫЋбЁЃЌЬюзжФИЃЉЃЛ
ЕФЫЕЗЈе§ШЗЕФга_________ЃЈЫЋбЁЃЌЬюзжФИЃЉЃЛ
AЃЎКѓепгіЕНFeCl3ШмвКЯдзЯЩЋЃЌЖјЧАепВЛПЩ
BЃЎСНепЖМПЩвдгыNaHCO3ШмвКЗДгІЗХГіCO2
CЃЎСНепЖМПЩвдгыЧтбѕЛЏФЦШмвКЗЂЩњЗДгІЃЌЕБСНепЮяжЪЕФСПЯрЕШЪБЃЌЯћКФЧтбѕЛЏФЦЕФСПВЛЯрЕШ
DЃЎСНепЖМПЩвдгыЧтЦјЗЂЩњМгГЩЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЪЕбщЕФУшЪіе§ШЗЕФЪЧЃЈ ЃЉ
бЁЯю | ЪЕбщФкШн | ЯжЯѓЛђНсТл |
A | ЯђЦНКтЬхЯЕFeCl3+3KSCN | ШмвКбеЩЋУїЯдБфЧГ |
B | гУNaOHШмвКЕЮЖЈбЮЫсЃЈЗгЬЊзїжИЪОМСЃЉжСжеЕу | ШмвКгЩКьЩЋБфЮЊЮоЩЋ |
C | ЖўбѕЛЏСђЭЈШыЕНЫсадИпУЬЫсМиШмвКжа | ЫсадИпУЬЫсМиШмвКЭЪЩЋЃЌSO2ОпгаЛЙдад |
D | НЋФЦжУгквЛЖЈСПЕФввДМжа | ФЦИЁдквКУцЩЯОчСвЗДгІ |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЉЗЯОЩЫмСЯПЩВЩгУЯТСаЗНЗЈДІРэЃКНЋЗЯЫмСЯИєОјПеЦјМгЧПШШЃЌЪЙЦфБфГЩгагУЕФЮяжЪЃЌЪЕбщзАжУШчЭМ
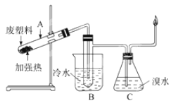
МгШШОлБћЯЉЗЯЫмСЯЕУЕНЕФВњЮяШчБэЃК
ВњЮя | ЧтЦј | МзЭщ | ввЯЉ | БћЯЉ | БН | МзБН | ЬМ |
жЪСПЗжЪ§(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)ЪдЙмAжаВагрЮягаЖржжгУЭОЃЌШчЯТСазЊЛЏОЭПЩжЦШЁИпОлЮяОлввШВЃК
![]()
аДГіЗДгІ(2)ЕФЛЏбЇЗНГЬЪН__________________________________ЁЃ
(2)ЪдЙмBЪеМЏЕНЕФВњЦЗжаЃЌФмЪЙЫсадИпУЬЫсМиШмвКЭЪЩЋЕФЮяжЪЃЌЦфвЛТШДњЮяга____жжЁЃ
(3)ОзЖаЮЦПCжафхЫЎГфЗжЮќЪеЃЌЪЃгрЦјЬхОЙ§ИЩдяКѓЕФЦНОљЯрЖдЗжзгжЪСПЮЊ_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкCF3COOHЫЎШмвКжаНЋМзЭщжБНгзЊЛЏЮЊCH3OHЕФЗДгІЛњРэШчЭМЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
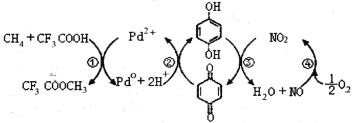
A.ЫљКЌВПЗждЊЫиЕквЛЕчРыФмЃКC<N<O<F
B.ЗДгІЂлЕФбѕЛЏМСЮЊЖдБНЖўЗг
C.ДЫЗЈгЩМзЭщжЦШЁМзДМЕФЗНГЬЪНЮЊЃК2CH4+O2 2CH3OH
2CH3OH
D.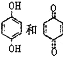 ОљПЩвдгыХЈфхЫЎЗДгІЃЌЧвЗДгІРраЭЯрЭЌ
ОљПЩвдгыХЈфхЫЎЗДгІЃЌЧвЗДгІРраЭЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЛњЛЏбЇжЊЪЖдкЩњЛюжагІгУЙуЗКЁЃ
ЃЈ1ЃЉЬЧРрЁЂгЭжЌКЭЕААзжЪЪЧЖЏЮяадКЭжВЮяадЪГЮяжаЕФЛљБОгЊбјЮяжЪЁЃ
ЂйЯТСагаЙиЫЕЗЈжаЃЌе§ШЗЕФЪЧ________________ЃЛ
AЃЎУоЁЂТщЁЂФОВФЁЂВЯЫПЕФжївЊГЩЗжЖМЪЧЯЫЮЌЫи
BЃЎгЭжЌЪЧВњЩњФмСПзюИпЕФгЊбјЮяжЪ
CЃЎЕААзжЪдкШЫЬхФкЗЂЩњЫЎНтзюжеЩњГЩАБЛљЫс
DЃЎЬЧРрЖМЪЧгаЬ№ЮЖЕФЮяжЪ
EЃЎЕэЗлЁЂЯЫЮЌЫиЁЂЕААзжЪЖМЪЧЬьШЛИпЗжзгЛЏКЯЮя
FЃЎСђЫсяЇЛђввЫсЧІШмвКМгШыЕНЕААзжЪШмвКжаЃЌЕААзжЪЖМФмДгШмвКжаЮіГі
ЂкЦЯЬбЬЧЪЧзюживЊЁЂзюМђЕЅЕФЕЅЬЧЃЌГ§СЫЪЧвЛжжгЊбјЮяжЪЃЌЛЙФмгУдкжЦОЕЕШЙЄвЕЩЯЁЃаДГіЦЯЬбЬЧЗЂЩњвјОЕЗДгІЕФЛЏбЇЗНГЬЪНЃК_____________________________________________ЁЃ
ЃЈ2ЃЉЦЛЙћЫсГЃгУзїЦћЫЎЁЂЬЧЙћЕФЬэМгМСЃЌЦфНсЙЙМђЪНЮЊ![]() ЃЌИУЗжзгжаЙйФмЭХЕФУћГЦЮЊ________________ЃЌПЩвдКЭДМРрЮяжЪЗЂЩњ__________ЗДгІЃЌЛЙПЩвдЗЂЩњЗжзгФкЭбЫЎЩњГЩТэРДЫсЃЌТэРДЫсФмЪЙфхЫЎЭЪЩЋЃЌдђТэРДЫсЕФНсЙЙМђЪНЮЊ_________________ЁЃ
ЃЌИУЗжзгжаЙйФмЭХЕФУћГЦЮЊ________________ЃЌПЩвдКЭДМРрЮяжЪЗЂЩњ__________ЗДгІЃЌЛЙПЩвдЗЂЩњЗжзгФкЭбЫЎЩњГЩТэРДЫсЃЌТэРДЫсФмЪЙфхЫЎЭЪЩЋЃЌдђТэРДЫсЕФНсЙЙМђЪНЮЊ_________________ЁЃ
ЃЈ3ЃЉЪЕбщЪвКЯГЩввЫсввѕЅЕФВНжшШчЯТЃКдкдВЕзЩеЦПФкМгШыввДМЁЂХЈСђЫсКЭввЫсЃЌЦППкЪњжБАВзАЭЈгаРфШДЫЎЕФРфФ§ЙмЃЈЪЙЗДгІЛьКЯЮяЕФеєЦјРфФ§ЮЊвКЬхСїЛиЩеЦПФкЃЉЃЌМгШШЛиСївЛЖЮЪБМфКѓЛЛГЩеєСѓзАжУНјааеєСѓЃЈШчЯТЭМЫљЪОЃЉЃЌЕУЕНКЌгаввДМЁЂввЫсКЭЫЎЕФввЫсввѕЅДжВњЦЗЁЃЧыЛиД№ЯТСаЮЪЬтЃКЃЈвбжЊЃКввДМЁЂввЫсЁЂввЫсввѕЅЕФЗаЕувРДЮЪЧ78.4ЁцЁЂ118ЁцЁЂ77.1ЁцЃЉ

ЂйдкЩеЦПжаГ§СЫМгШыввДМЁЂХЈСђЫсКЭввЫсЭтЃЌЛЙгІЗХШыМИПщЫщДЩЦЌЃЌЦфФПЕФЪЧ_____________ЃЛ
ЂкЩњГЩввЫсввѕЅЕФЗДгІЪЧПЩФцЗДгІЃЌЗДгІЮяВЛФмЭъШЋБфГЩЩњГЩЮяЃЌЗДгІвЛЖЮЪБМфКѓЃЌОЭДяЕНСЫИУЗДгІЕФЯоЖШЃЌМДДяЕНЛЏбЇЦНКтзДЬЌЁЃЯТСаУшЪіФмЫЕУїИУЗДгІвбДяЕНЛЏбЇЦНКтзДЬЌЕФгаЃЈЬюађКХЃЉ___________________ЃЛ
AЃЎЕЅЮЛЪБМфРяЃЌЩњГЩ1molввЫсввѕЅЃЌЭЌЪБЩњГЩ1molЫЎ
BЃЎЕЅЮЛЪБМфРяЃЌЩњГЩ1molввЫсввѕЅЃЌЭЌЪБЩњГЩ1molввЫс
CЃЎЕЅЮЛЪБМфРяЃЌЯћКФ1molввДМЃЌЭЌЪБЯћКФ1molввЫс
DЃЎе§ЗДгІЕФЫйТЪгыФцЗДгІЕФЫйТЪЯрЕШ
EЃЎЛьКЯЮяжаИїЮяжЪЕФХЈЖШВЛдйБфЛЏ
ЂлЯжФтЗжРыКЌввЫсЁЂввДМКЭЫЎЕФввЫсввѕЅДжВњЦЗЃЌЯТЭМЪЧЗжРыВйзїВНжшСїГЬЭМЁЃ

ЪдМСaЪЧ______ЃЌЗжРыЗНЗЈЂйЪЧ_______ЃЛЗжРыЗНЗЈЂкЪЧ________ЃЌЪдМСbЪЧ________ЃЛ
ЂмаДГіC Ёњ D ЗДгІЕФЛЏбЇЗНГЬЪН________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊВнЫсЮЊЖўдЊШѕЫсЃКH2C2O4![]() HC2OЃЋHЃЋЁЁKa1ЁЂHC2O
HC2OЃЋHЃЋЁЁKa1ЁЂHC2O![]() C2O
C2O![]() ЃЋHЃЋЁЁKa2ЁЃГЃЮТЯТЃЌЯђФГХЈЖШЕФH2C2O4ШмвКжаж№ЕЮМгШывЛЖЈХЈЖШЕФKOHШмвКЃЌЫљЕУШмвКжаH2C2O4ЁЂHC2OЁЂC2O
ЃЋHЃЋЁЁKa2ЁЃГЃЮТЯТЃЌЯђФГХЈЖШЕФH2C2O4ШмвКжаж№ЕЮМгШывЛЖЈХЈЖШЕФKOHШмвКЃЌЫљЕУШмвКжаH2C2O4ЁЂHC2OЁЂC2O![]() Ш§жжЮЂСЃЕФЮяжЪЕФСПЗжЪ§(ІФ)гыШмвКpHЕФЙиЯЕШчЭМЫљЪОЃЌдђЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
Ш§жжЮЂСЃЕФЮяжЪЕФСПЗжЪ§(ІФ)гыШмвКpHЕФЙиЯЕШчЭМЫљЪОЃЌдђЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧ(ЁЁЁЁ)

A. Ka1=10Ѓ1.2
B. pHЃН2.7ЪБШмвКжаЃК![]() ЃН1000
ЃН1000
C. НЋЯрЭЌЮяжЪЕФСПЕФKHC2O4КЭK2C2O4ЙЬЬхЭъШЋШмгкЫЎБуЪЧХфЕУpHЮЊ4.2ЕФЛьКЯвК
D. ЯђpHЃН1.2ЕФШмвКжаМгKOHШмвКЃЌНЋpHдіДѓжС4.2ЕФЙ§ГЬжаЫЎЕФЕчРыГЬЖШвЛжБдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃЫЎжадЬВизХЗсИЛЕФзЪдДЁЃКЃЫЎзлКЯРћгУЕФСїГЬЭМШчЯТЁЃ
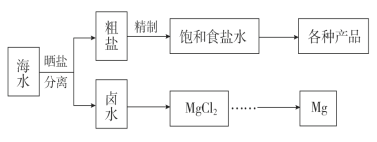
ЃЈ1ЃЉгУNaClзїдСЯПЩвдЕУЕНЖржжВњЦЗЁЃ
ЂйЙЄвЕЩЯгЩNaClжЦБИН№ЪєФЦЕФЛЏбЇЗНГЬЪНЪЧ______ЁЃ
ЂкаДГіВњЮяТШЦјжЦБИЁА84ЁБЯћЖОвКЕФРызгЗНГЬЪНЃК______ЁЃ
ЂлNaClвВЪЧКюЪЯжЦМюЗЈЕФживЊЗДгІЮяжЎвЛЃЌаДГіКюЪЯжЦМюЗЈЙ§ГЬжаЩцМАЕНЕФСНИіжївЊЗНГЬЪНЃК__________ ЃЌ __________ЁЃ
ЃЈ2ЃЉВЩгУЁАПеЦјДЕГіЗЈЁБДгХЈКЃЫЎДЕГіBr2ЃЌВЂгУДПМюЮќЪеЁЃМюЮќЪефхЕФжївЊЗДгІЪЧBr2ЃЋNa2CO3ЃЋH2OЈDЁњNaBrЃЋNaBrO3ЃЋNaHCO3ЃЌЮќЪе1 mol Br2ЪБЃЌзЊвЦЕФЕчзгЪ§ЮЊ________molЁЃ
ЃЈ3ЃЉКЃЫЎЬсУОЕФвЛЖЮЙЄвеСїГЬШчЯТЭМЃК
ТБЫЎ![]()
![]() MgЃЈOHЃЉ2
MgЃЈOHЃЉ2![]() MgCl2ШмвКЁњMgCl2ЁЄ6H2OЁњMgCl2
MgCl2ШмвКЁњMgCl2ЁЄ6H2OЁњMgCl2![]() Mg
Mg
ЂйВЩгУЪЏФЋЕчМЋЕчНтШлШкЕФТШЛЏУОЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪН_________ЃЛ
ЂкЕчНтЪБЃЌШєгаЩйСПЫЎДцдкЃЌдђВЛФмЕУЕНУОЕЅжЪЃЌаДГігаЙиЗДгІЕФЛЏбЇЗНГЬЪН__________ЁЃ
ЃЈ4ЃЉЗжРыГіДжбЮКѓЕФТБЫЎжадЬКЌзХЗсИЛЕФУОзЪдДЃЌОЙ§ЯТСаЭООЖПЩЛёЕУН№ЪєУОЃКЦфжаЃЌгЩMgCl2ЁЄ6H2OжЦШЁЮоЫЎMgCl2ЕФВПЗжзАжУЃЈЬњМмЬЈЁЂОЦОЋЕЦвбТдЃЉШчЯТЃК
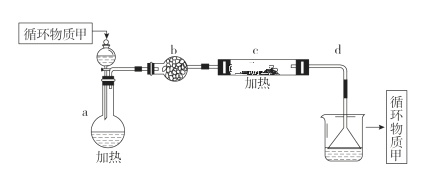
ЂйЩЯЭМжаЃЌзАжУaгЩ________ЁЂ________ЁЂЫЋПзШћКЭЕМЙмзщГЩЁЃ
ЂкбЛЗЮяжЪМзЕФУћГЦЪЧ________ЁЃ
ЂлжЦШЁЮоЫЎТШЛЏУОБиаыдкТШЛЏЧтДцдкЕФЬѕМўЯТНјааЃЌдвђЪЧ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com