
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是 ( )
A.A、B两种单质的摩尔质量之比为1∶4
B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数之比为3∶1
D.反应前后气体分子数之比为1∶4
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A. 做CO还原CuO的实验时,尾气用点燃的方法除去
B. FeCl2、Na2O2、Fe(OH)3均可通过化合反应生成
C. 金属钠、钾起火,可用泡沫灭火器灭火
D. “水滴石穿”是因为溶解了CO2的雨水与CaCO3作用生成Ca(HCO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2NO2 (g)⇌N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
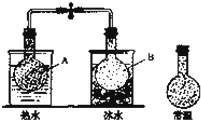
|
| A. | 上述过程中,A烧瓶内正、逆反应速率均加快 |
|
| B. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 |
|
| C. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
|
| D. | 反应2NO2(g)⇌N2O4(g)的逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要意义.
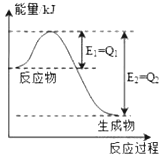
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式: N2(g)+3H2(g)⇌2NH3(g)△H=﹣2(Q2﹣Q1)kJ•mol﹣1 (△H的数值用含字母Q1、Q2的代数式表示).
(2)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)⇌2SO3(g),混合体系中SO3的体积分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题,

①2SO3⇌2SO2+O2的△H < 0.
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 > K2;
③反应进行到状态D时,v正 > v逆(填<、>或=).
(3)Cl2合成有机物时会产生副产物HC1.4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)可实现氯的循环利用.
①该反应平衡常数的表达式K= 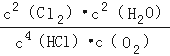 ;若反应容器的容积为2L,4min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 0.125 mol/L∙min.
;若反应容器的容积为2L,4min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 0.125 mol/L∙min.
②若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 b .
a.4v正(HCl)=v逆(O2)
b.又加入1mol O2,达新平衡时,HCl的转化率增大
c.分离出H2O,达新平衡时,v正(HCl)增大
③图2是该反应两种投料比[n (HCl):n (O2)分别为4:1和2:1下,反应温度对HCl平衡转化率影响的曲线.下列叙述正确的是 c .
a.其他条件不变,升高温度,平衡常数K值增大
b.若平衡常数K值变大,达新平衡前v逆始终减小
c.若平衡常数K值变大,则平衡向正反应方向移动
④投料比为4:1、温度为400℃时,平衡混合物中
Cl2的物质的量分数是 35.3 %.(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的铜和浓硫酸在加热条件下充分反应,向反应后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是
( )
A.溶液中c(Na+)=2c(SO )
)
B.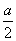 mol>沉淀的物质的量>0
mol>沉淀的物质的量>0
C.沉淀的物质的量=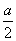 mol
mol
D.原浓硫酸中H2SO4的物质的量>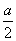 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与此理念相违背的是( )
A.在食品中大量添加苯甲酸钠等防腐剂,延长其保质期
B.将“地沟油”制成肥皂,可以提高资源的利用率
C.加快高效洁净能源转换技术的开发,缓解能源危机
D.用“三层复合石头纸”替代木浆纸,减少树木砍伐
查看答案和解析>>
科目:高中化学 来源: 题型:
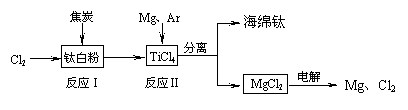 21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
 ② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)
沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子
方程式为 。
(2)反应Ⅰ在800~900℃下进行,还生成一种可燃
性无色气体,该反应的化学方程式为 ;
反应Ⅱ的热化学方程式为 。
(3)该工艺流程中,可以循环使用的物质有 。
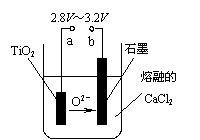
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 极,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氧化物的叙述正确的是( )
①酸性氧化物肯定是非金属氧化物
②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物
④金属氧化物都是碱性氧化物
⑤酸性氧化物均可与水反应生成相应的酸
⑥不能跟酸反应的氧化物一定能跟碱反应
A、①②③④ B、⑤⑥ C、②③⑥ D、③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com