
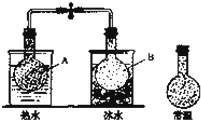
已知反应:2NO2 (g)⇌N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
|
| A. | 上述过程中,A烧瓶内正、逆反应速率均加快 |
|
| B. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 |
|
| C. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
|
| D. | 反应2NO2(g)⇌N2O4(g)的逆反应为放热反应 |
| 化学平衡的影响因素. . | |
| 专题: | 化学平衡专题. |
| 分析: | A.升高温度,正、逆反应速率都增大; B.B烧瓶内气体颜色变浅,说明平衡向生成N2O4方向移动; C.容器的容积不变,混合气体的质量不变,结合ρ=判断. D.放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2,降低温度平衡向生成N2O4方向移动. |
| 解答: | 解:A.升高温度,正、逆反应速率都增大,故A正确; B.B烧瓶内气体颜色变浅,说明平衡向生成N2O4方向移动,B烧瓶内c(NO2)减小,c(N2O4)增大,故B正确; C.容器的容积不变,混合气体的质量不变,由ρ=可知,A烧瓶、B烧瓶内气体密度都不变,故C正确; D.放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2,降低温度平衡向生成N2O4方向移动,故反应2NO2(g)⇌N2O4(g)的正反应为放热反应,故D错误; 故选D. |
| 点评: | 本题考查化学平衡的影响因素,难度不大,根据不同温度下颜色变化判断平衡移动方向是关键. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
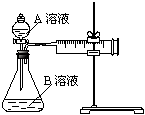 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
 ⑴写出草酸溶于水的电离方程式: 。
⑴写出草酸溶于水的电离方程式: 。
⑵该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是:① ②(填:>、<、=)。
⑶若实验①在2 min末收集了4.48 mL CO2(标准状况下),则
在2 min末, c(MnO4-)= mol/L。
⑷除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。
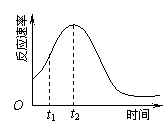
⑸小组同学发现反应速率随时间变化如上图所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热,② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液的说法中,正确的是
A.含H+的溶液显酸性,含OH—的溶液显碱性
B.用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体
C.某饱和溶液变成不饱和溶液,溶质的质量分数一定减小
D.向含有BaCl2和NaOH的混合液中通入足量的二氧化硫,最终会有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
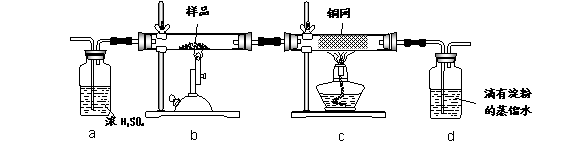 |
现称取研细的黄铜矿样品1.840g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的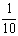 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
 |
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1,推测含1mol HCl的稀溶液与含1mol NH3的稀溶液反应放出的热量( )
|
| A. | 小于57.3 kJ | B. | 等于57.3 kJ | C. | 大于57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g)△H<0,在恒容的密闭容器中,下列有关说法正确的是( )
|
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
|
| B. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
|
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
|
| D. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol•L﹣1,在一定条件下发生反应:A(g)+B(g)⇌2C(g),该温度下,此反应的平衡常数为4,则A的转化率为( )
|
| A. | 20% | B. | 30% | C. | 40% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是 ( )
A.A、B两种单质的摩尔质量之比为1∶4
B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数之比为3∶1
D.反应前后气体分子数之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
锌溴液流电池是一种新型电化学储能装置(如下图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
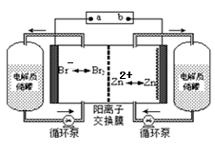
A.充电时电极a连接电源的负极
B.放电时负极的电极反应式为Zn—2e-=Zn2+
C.放电时左侧电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止Br2与Zn直接发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com