
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g)△H<0,在恒容的密闭容器中,下列有关说法正确的是( )
|
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
|
| B. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
|
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
|
| D. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| 化学平衡的调控作用;化学平衡建立的过程. . | |
| 专题: | 化学平衡专题. |
| 分析: | A、平衡常数只受温度影响,从平衡移动的方向判断平衡常数的变化; B、反应达到平衡时,不同物质表示的正、逆反应速率之比等于化学计量数之比; C、催化剂能加快反应速率,但不影响平衡的移动; D、可逆反应中,加入一种反应物,平衡向正方向移动,以此判断转化率变化. |
| 解答: | 解:A、正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故A错误; B、单位时间内消耗NO和N2的物质的量比为1:2,二者分别表示正逆反应速率,所以二者表示的速率之比等于化学计量数之比时,反应到达平衡,故B正确; C、使用催化剂平衡不移动,废气中氮氧化物的转化率不变,故C错误; D、增大一种反应物浓度,其它反应物转化率会增大,所以平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率增大,故D错误. 故选B. |
| 点评: | 本题考查外界条件对化学反应速率的影响、平衡状态的判断等,做题时注意平衡常数的变化以及平衡状态的判断方法,题目难度不大. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
欲配制100mL 1.0 mol/L Na2SO4溶液,正确的方法是( )
① 将14.2 g Na2SO4 溶于100mL水中;② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL;③ 将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①② B.②③ C.①③ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-。将该混合物溶于水后得澄清溶液.现取3份l00mL该溶液分别进行如下实验:
| 试验序号 | 试验内容 | 试验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体 1.12L(已折算成标准状况下的体积)[][] |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为 6.27g,第二次称量读数为 2.33g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验l~3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mo1·L-) |
(3)试确定K+是否存在? ,判断的理由
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨所需的氢气可由水煤气反应制得,其中的一步反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g);△H=﹣43kJ•mol﹣1对于上述反应,下列措施中能提高CO转化率的是( )
|
| A. | 增大压强 | B. | 升高温度 |
|
| C. | 增大水蒸气的浓度 | D. | 增大CO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2NO2 (g)⇌N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
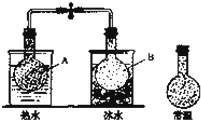
|
| A. | 上述过程中,A烧瓶内正、逆反应速率均加快 |
|
| B. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 |
|
| C. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
|
| D. | 反应2NO2(g)⇌N2O4(g)的逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,在定压容器a与定容容器b中,分别通入等量且体积比为1:3的N2和H2,开始时体积相同,达到平衡时,N2的转化率是( )
|
| A. | a大 | B. | b大 | C. | a、b一样大 | D. | 不一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要意义.
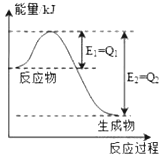
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式: N2(g)+3H2(g)⇌2NH3(g)△H=﹣2(Q2﹣Q1)kJ•mol﹣1 (△H的数值用含字母Q1、Q2的代数式表示).
(2)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)⇌2SO3(g),混合体系中SO3的体积分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题,

①2SO3⇌2SO2+O2的△H < 0.
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 > K2;
③反应进行到状态D时,v正 > v逆(填<、>或=).
(3)Cl2合成有机物时会产生副产物HC1.4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)可实现氯的循环利用.
①该反应平衡常数的表达式K= 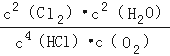 ;若反应容器的容积为2L,4min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 0.125 mol/L∙min.
;若反应容器的容积为2L,4min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 0.125 mol/L∙min.
②若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 b .
a.4v正(HCl)=v逆(O2)
b.又加入1mol O2,达新平衡时,HCl的转化率增大
c.分离出H2O,达新平衡时,v正(HCl)增大
③图2是该反应两种投料比[n (HCl):n (O2)分别为4:1和2:1下,反应温度对HCl平衡转化率影响的曲线.下列叙述正确的是 c .
a.其他条件不变,升高温度,平衡常数K值增大
b.若平衡常数K值变大,达新平衡前v逆始终减小
c.若平衡常数K值变大,则平衡向正反应方向移动
④投料比为4:1、温度为400℃时,平衡混合物中
Cl2的物质的量分数是 35.3 %.(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的铜和浓硫酸在加热条件下充分反应,向反应后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是
( )
A.溶液中c(Na+)=2c(SO )
)
B.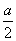 mol>沉淀的物质的量>0
mol>沉淀的物质的量>0
C.沉淀的物质的量=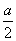 mol
mol
D.原浓硫酸中H2SO4的物质的量>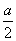 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,可逆反应A(g)+ 3 B(g) 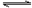 2 C(g)达到平衡的标志是
2 C(g)达到平衡的标志是
A.C生成的速率与C分解的速率相等
B.A、B、C的浓度均相等
C.单位时间内生成n mol A,同时生成3n mo1B
D.A、B、C的分子数之比为l:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com