
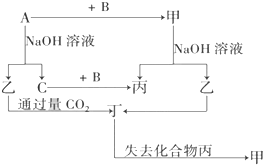
 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
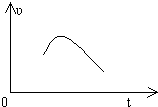 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )| A、①④ | B、③④ | C、①②③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤、萃取、分液 |
| B、萃取、分液、蒸馏 |
| C、分液、蒸馏、萃取 |
| D、萃取、蒸馏、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com