
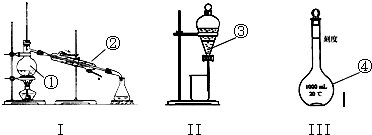
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 物质 | 性质 |
| Fe2S3 Al2S3 | 在水溶液中不存在 |
| FeS | 黑色,难溶于水,可溶于盐酸 |
| CuS | 黑色,难溶于水,难溶于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、渗析、蒸馏、萃取 |
| B、渗析、分液、过滤 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
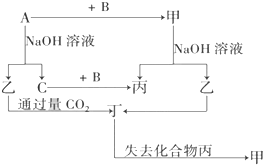 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸、氢氧化钠、氯化钠 |
| B、氢氧化钠、氢氧化钡、硫酸 |
| C、硫酸氢钠、碳酸钠、氢氧化钠 |
| D、硫酸铜、盐酸、硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
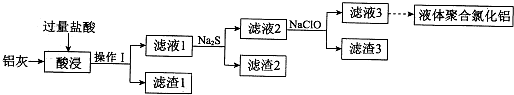
 Ⅰ、阅读、分析下列两个材料:
Ⅰ、阅读、分析下列两个材料:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分解反应 | B、化合反应 |
| C、置换反应 | D、氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
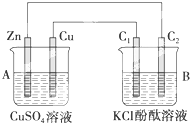 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com