


科目:高中化学 来源: 题型:
| A、X与Y不可能位于同一主族 |
| B、X与Y一定位于同一周期 |
| C、X与Y可能形成共价化合物XY |
| D、X与Y可能形成离子化合物XY |
查看答案和解析>>
科目:高中化学 来源: 题型:
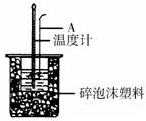
| A、稍过量的氢氧化钠是确保盐酸完全反应 |
| B、仪器A的名称是环形玻璃搅拌棒 |
| C、在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H偏大 |
| D、用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
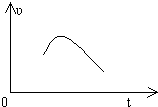 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )| A、①④ | B、③④ | C、①②③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的铜与浓硝酸反应可生成NO |
| B、Fe在O2中的燃烧产物可用于制红色涂料 |
| C、Na、Cu可以分别用电解冶炼法、热还原法得到 |
| D、Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
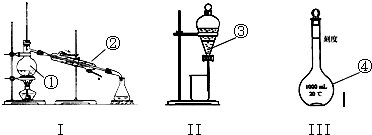
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由电能转化为化学能的装置叫电解池 |
| B、在电解池中跟直流电源的正极相连的电极是电解池的阳极 |
| C、在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极 |
| D、电解池中阴极发生还原反应,阳极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com