
【题目】用下面的方案检验试液中的![]() ,其中方案设计严密的是( )
,其中方案设计严密的是( )
A. 试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
C. 试液![]() 白色沉淀
白色沉淀![]() 白色沉淀
白色沉淀
D.试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)按系统命名法命名有机物CH3CH(C2H5)CH(CH3)2的名称是_____________________________。
(2)电石气的电子式为___________________。
(3)实验室制乙烯的反应方程式_________________________________。
(4)不能发生消去反应的分子量最小的氯代烃的分子式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最早使用的充电电池。目前汽车上使用的电瓶大多数仍是铅蓄电池,其电池反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,下列说法正确的是
2PbSO4+2H2O,下列说法正确的是
A.该电池放电过程中,溶液的pH值增大
B.放电时,电池的负极反应为:Pb-2e-= Pb2+
C.该电池的充、放电过程互为可逆反应
D.放电过程中,电子的流向为:负极→导线→正极→H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.少量碳酸氢钠溶液逐滴加入到氢氧化钙溶液中:![]()
B.在溴化亚铁溶液中通入过量的氯气:![]()
C.在NaHSO4溶液中滴入Ba(OH)2溶液至中性:![]()
D.少量二氧化硫通入漂白粉溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1molL﹣1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
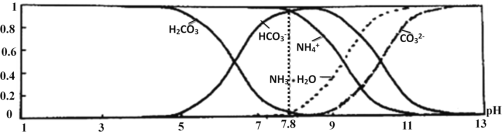
下列说法不正确的是( )
A. 分析可知,常温下Kb(NH3H2O)>Ka1(H2CO3)
B. 0.1 molL-1 NH4HCO3溶液中存在:c(NH3H2O)=c(H2CO3)+c(CO32-)
C. 当溶液的pH=9时,溶液中存在:c(HCO3-)> c(NH4+)>c(NH3H2O)>c(CO32-)
D. 向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3﹣浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2═NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是
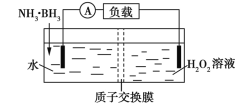
A. 正极的电极反应式为2H++2![]() ═H2↑
═H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作一段时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的反应过程中能量变化如图所示。下列叙述不正确的是( )
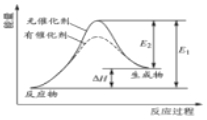
A.该反应的能量变化与氯化铵晶体和氢氧化钡晶体反应相同
B.该反应的△H=E1E2
C.若生成物中某一物质由气态变成液态,则该反应的△H变大
D.加入催化剂可以同时降低E1、E2,但不改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气还原氮氧化物的反应为:
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___。(用含△H1、△H2的式子表示)
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____。
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0,测得相关数据如表:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/molL1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/molL1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①05min,用NO2的浓度变化表示的反应速率为______。
②以下表述能说明该反应己达到平衡状态的是_____。
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡___(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=____。
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
离子 | NO3 | NO2 | Cl |
c/(molL1) | 2.0×104 | 1.0×104 | 1.75×104 |
①NaClO2溶液显碱性,用离子方程式解释原因_____。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热法是铝与某些金属氧化物反应获得高熔点金属单质的方法。工业上可用于制造无碳或低碳铁合金。铝粉和赤铁矿发生铝热反应的化学方程式为:Fe2O3+2Al![]() 2Fe+Al2O3。
2Fe+Al2O3。
(1)上述反应中,作为氧化剂的物质是__,化合价升高的元素是__。
(2)若反应中消耗了0.2molAl,生成Fe的物质的量为__mol,转移电子的物质的量为__mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com