
【题目】铁及其化合物在日常生活中应用广泛。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是____________________________;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:________________________________。
(2)氧化铁是重要的工业颜料,下面是制备氧化铁的一种方法(铁屑表面常附着油污),其流程如下:
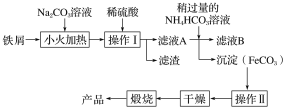
①操作Ⅰ的名称是________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________________。
②滤液A中加入稍过量的NH4HCO3溶液,生成沉淀的同时有一种气体(能使澄清石灰水变浑浊)产生,写出其化学方程式: __________________________________。
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,加酸溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,重复滴定2~3次,消耗酸性KMnO4溶液体积的平均值为20.00 mL。
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是________(填序号)。
a.硝酸 b.盐酸 c.硫酸
②上述产品中Fe2O3的质量分数为________。
【答案】生铁中含有碳等杂质 4Fe2++O2+4H+===4Fe3++2H2O 过滤(溶解过滤也可) 沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2~3次 FeSO4+2NH4HCO3===FeCO3↓+(NH4)2SO4+CO2↑+H2O c 76%
【解析】
(1)生铁是铁碳合金,碳与稀硫酸不反应;Fe2+具有还原性,易被氧气氧化为Fe3+;(2)铁屑用纯碱溶液洗去油污,加稀硫酸充分反应,经过过滤分离,在滤液中加入过量的碳酸氢铵溶液得到碳酸亚铁,再经过过滤、洗涤,然后再干燥,煅烧得到氧化铁;(3)①硝酸具有强氧化性,酸性高锰酸钾溶液具有强氧化性,能氧化氯离子;②FeO与KMnO4反应的关系式是5FeO![]() KMnO4,根据关系式计算Fe2O3的质量分数。
KMnO4,根据关系式计算Fe2O3的质量分数。
(1)生铁是铁碳合金,碳与稀硫酸不反应,所以取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况);Fe2+具有还原性,易被氧气氧化为Fe3+,反应的离子方程式是4Fe2++O2+4H+===4Fe3++2H2O;(2) ①操作Ⅰ是固液分离,名称是过滤;洗涤操作的具体方法为沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2~3次;②硫酸亚铁溶液中加入稍过量的NH4HCO3溶液生成碳酸亚铁沉淀和二氧化碳气体和硫酸铵,反应化学方程式是FeSO4+2NH4HCO3===FeCO3↓+(NH4)2SO4+CO2↑+H2O;(3)①亚铁离子具有还原性,硝酸具有强氧化性,不能用硝酸酸化,酸性高锰酸钾溶液具有强氧化性,能氧化氯离子,不能用盐酸酸化,故选c;②设样品中FeO的质量为xg
5FeO![]() KMnO4
KMnO4
360g 1mol
xg 0.02L![]() 0.01mol·L-1
0.01mol·L-1![]() 10
10
![]()
x=0.72g,Fe2O3的质量位3.0 g-0.72g=2. 28g,产品中Fe2O3的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2A(g)+2B(g)![]() C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO和CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途不对应的是( )
A. 铝合金的密度小,硬度大,可用作建筑材料
B. 食品工业中用Na2CO3作焙制糕点的膨松剂
C. FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板
D. 二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化的原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH =-632 kJ·mol-1。下图为H2S燃料电池的示意图。下列说法正确的是
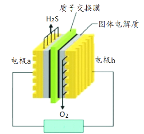
A. 电极b为电池的负极
B. 电极b上发生的电极反应为:O2 + 2H2O + 4e- = 4OH-
C. 电路中每流过4 mol电子,电池会产生632 kJ电能
D. 每34 g H2S参与反应,有2 molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 可以用NaOH溶液鉴别MgCl2和AlCl3 B. 可以用溴水鉴别甲烷和乙烯
C. 可以用分液漏斗分离乙酸和乙醇 D. 可以用NaOH溶液除去苯中少量的Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为CH3—CH=CH—Cl,该有机物能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液反应生成白色沉淀 ⑦加聚反应
A.以上反应均可发生B.只有⑦不能发生
C.只有⑥不能发生D.只有②不能发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com