
【题目】测定三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)晶体中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是_______________________________________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为______________________。
【答案】滴入最后一滴KMnO4溶液,溶液恰好变为浅紫红色,且半分钟内红色不消失 ![]() ×100%
×100%
【解析】
(1) 滴入最后一滴KMnO4溶液,溶液变成浅紫红色且半分钟内不变色是滴定的终点;
(2)亚铁离子变成铁离子,高锰酸根离子变成二价的锰离子,所以铁离子与高锰酸根离子的物质的量之比为5:1,所以铁元素的质量为:![]() ,据此计算。
,据此计算。
(1) 滴入最后一滴KMnO4溶液,溶液变成浅紫红色且半分钟内不变色是滴定的终点,故答案为:滴入最后一滴KMnO4溶液,溶液恰好变为浅紫红色,且半分钟内红色不消失;
(2)亚铁离子变成铁离子,高锰酸根离子变成二价的锰离子,所以铁离子与高锰酸根离子的物质的量之比为5:1,所以铁元素的质量为:![]() ,所以该晶体中铁的质量分数的表达式为:
,所以该晶体中铁的质量分数的表达式为:![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量的FeSO4、H2SO4和少量的Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁的工艺流程如图所示:
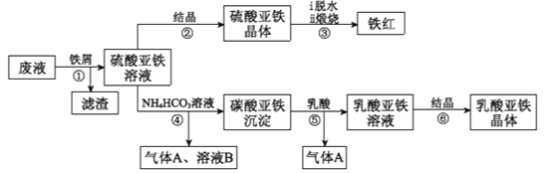
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiO2+水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
回答下列问题:
(1)TiOSO4中钛元素的化合价是____________,步骤①中分离硫酸亚铁溶液和滤渣的操作是___________。
(2)滤渣的主要成分为TiO2·xH2O,结合离子方程式解释得到滤渣的原因:________。
(3)从硫酸亚铁溶液中得到硫酸亚铁晶体的操作方法是____________________;硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应的氧化剂和还原剂的物质的量之比为______。
(4)步骤④中发生反应的离子方程式为______________________。
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及____________________。
(6)实验室中检验溶液B中主要阳离子的方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置。
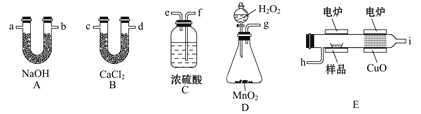
(1)产生的氧气按从左到右的流向,所选装置各导管的连接顺序是___________。
(2)C装置中浓H2SO4的作用是________。
(3)D装置中MnO2的作用是_____________。
(4)燃烧管中CuO的作用是______________。
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54 g,则该有机物的实验式为_______。
(6)要确立该有机物的分子式,还要知道___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种翠绿色晶体,在日光下照射,会因感光而部分变深蓝色,故常用于工程制图,即“蓝图”。K3[Fe(C2O4)3]·3H2O的制备反应为:2FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 = 2K3[Fe(C2O4)3]·3H2O。
回答下列问题:
(1)上述氧化过程中,Fe(II)_____(答简化电子排布式)变为Fe(III)______(答外围电子排布图),基态Fe(III)电子占据______个不同轨道。
(2)对上述反应式中的短周期元素按照电负性由小到大排序为______。
(3)配合物K3[Fe(C2O4)3]的配位数为6,其配体C2O42—中的C的杂化方式为____杂化。
(4) H2O2属于______(填“极性”或“非极性”)分子。H2O2为二元弱酸,一级电离产物HO2—的立体构型是__________。H2O2沸点(150.2 ℃)比H2S沸点(-60.4 ℃)高,简要解释主要原因___________。
(5)将下列晶体的微粒配位数由大到小排序为________(填写代号)
① 金刚石;② 金属钾;③ 干冰
(6)FeO的晶胞结构为NaCl型,测知FeO晶胞边长为428pm,则此晶体中最近的Fe2+与Fe2+的距离为_________pm。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________。
(2)合成尿素的反应:2NH3(g)+CO(g)CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________。
已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1________(填“>”或“<”)126.5;其判断理由是__________。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
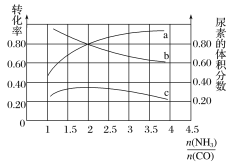
①若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。
②当![]() =________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
=________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
As(s)+![]() O2(g)=
O2(g)=![]() As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=______。
(2)写出砷酸(H3AsO4)的第二步电离方程式_______。
(3)NaH2AsO4溶液呈___(填“酸性”“中性”或“碱性”),试通过计算说明_______。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。
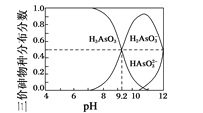
以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______。
(5)某化学兴趣小组同学欲探究可逆反应:AsO33-+I2+2OH-![]() AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
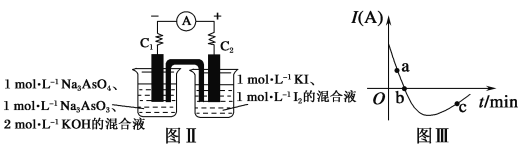
①图Ⅲ中AsO43-的逆反应速率:a__(填“>”“<”或“=”)b。
②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式______。
③能判断该反应达到平衡状态的是__。
a 2v(I-)正=v(AsO33-)逆 b 溶液的pH不再变化
c 电流表示数变为零 d 溶液颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同。下列叙述正确的是

A.WX的水溶液呈中性
B.元素非金属性的顺序为Y>Z>Q
C.Z的最高价氧化物对应的水化物是一元强酸
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
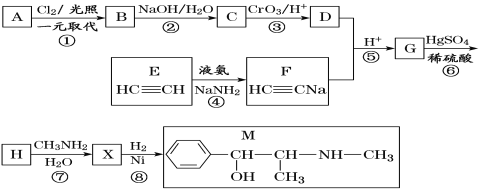
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
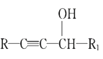
IV.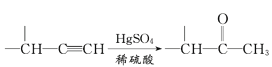
V.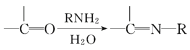
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com