
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3会快速分解为FeBr2。某化学小组同学用下图所示装置制备溴化亚铁,请回答相关问题:
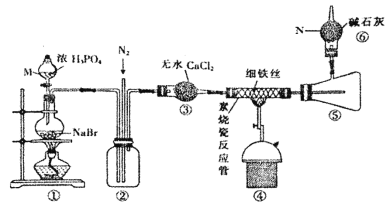
(1)仪器M、N的名称依次是________、________。
(2)装置⑥的作用是____________,从装置末端排出的气体是否需要处理________(填“是”或“否”)
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是__________。
(4)将浓磷酸换成浓硫酸同样能制得HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制HBr的原因是硫酸和磷酸都具备某种性质,该性质是________。
②溶液变橙黄色是因为发生了副反应___________(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度_____ (填“有”或“没有”)影响,理由是__________。
【答案】分液漏斗 干燥管 吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤ 是 使装置中残留的HBr被充分吸收,避免造成污染 难挥发性(或高沸点) 2NaBr+2H2SO4(浓) ![]() SO2↑+Br2↑+2H2O+Na2SO4 没有 SO2与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2
SO2↑+Br2↑+2H2O+Na2SO4 没有 SO2与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2
【解析】
根据装置图可知,装置①用来制备溴化氢,由于溴化亚铁易潮解变质,实验前需要通入氮气排除装置内的空气,装置②可以起到安全瓶的作用,防止装置④中导管出现堵塞,装置③为干燥生成的溴化氢,溴化氢与铁在装置④中反应生成FeBr2,800℃以上溴化亚铁可升华,装置⑤为收集生成的溴化亚铁,装置⑥可以吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤。据此分析解答。
(1)根据常见仪器的结构,仪器M为分液漏斗、N为球形干燥管,故答案为:分液漏斗;球形干燥管;
(2)根据上述分析,装置⑥可以吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤使溴化亚铁潮解变质;铁与溴化氢反应生成溴化亚铁,同时生成了氢气,从装置末端排出的气体中含有氢气,需要处理,否则可能发生爆炸危险,故答案为:吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤;是;
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通入N2可以使装置中残留的HBr被充分吸收,避免造成污染,故答案为:使装置中残留的HBr被充分吸收,避免造成污染;
(4)将浓磷酸换成浓硫酸同样能制得HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制HBr的原因是硫酸和磷酸都是难挥发性酸,故答案为:难挥发性(或高沸点);
②浓硫酸具有强氧化性,能够氧化溴离子生成溴单质,因此溶液变橙黄色是因为发生了副反应2NaBr+2H2SO4(浓) ![]() SO2↑+Br2↑+2H2O+Na2SO4,故答案为:2NaBr+2H2SO4(浓)
SO2↑+Br2↑+2H2O+Na2SO4,故答案为:2NaBr+2H2SO4(浓) ![]() SO2↑+Br2↑+2H2O+Na2SO4;
SO2↑+Br2↑+2H2O+Na2SO4;
③用浓硫酸作反应物时,进入素瓷烧反应管的HBr中含有溴蒸气和二氧化硫,二氧化硫与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2,不会影响产品纯度,故答案为:没有;SO2与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2。


科目:高中化学 来源: 题型:
【题目】已知某市售“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”中NaClO的物质的量浓度约为__mol/L。(保留1位小数)
(2)该同学参阅此“84消毒液”的配方,欲用NaClO固体配制480mL与市售物质的量浓度相同的“84消毒液”,下列说法正确的是___(填序号)。
A.如图所示的仪器中有三种是不需要的
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用98%(密度为1.84g/cm3)的浓硫酸配制500mL2.3mol/L的稀硫酸用于增强“84消毒液”的消毒能力。
①需用浓硫酸的体积为___mL。
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是____。
A.溶液中H2SO4的物质的量 B.溶液的浓度 C.溶液的质量 D.溶液的密度
③配制该稀硫酸过程中,下列情况会使所配制的溶液的浓度大于2.3mol/L的有___。
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )
A.  吸收HCl气体,并防止倒吸
吸收HCl气体,并防止倒吸
B. ![]() 准确量取一定体积K2Cr2O7标准溶液
准确量取一定体积K2Cr2O7标准溶液
C.  制备碳酸氢钠
制备碳酸氢钠
D.  蒸干FeCl3溶液制备无水FeC13
蒸干FeCl3溶液制备无水FeC13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新合成的某有机物A的结构简式如图,它含有1个手性碳原子,具有光学活性。若要使A通过反应失去光学活性,则发生的反应类型不可能是( )

A. 酯化反应 B. 水解反应 C. 银镜反应 D. 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法不正确的是

A. 原溶液中一定存在SO42–、CO32–和NH4+
B. 原溶液中一定不存在Ca2+,无法判断Cl–是否存在
C. 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D. 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在N2+3H2![]() 2NH3的反应中,各物质的起始浓度分别为:c(H2)=4 mol·L-1,c(N2)=3 mol·L-1,c(NH3)=0.5 mol·L-1,经3 min后,c(NH3)=0.8 mol·L-1,该反应的反应速率是
2NH3的反应中,各物质的起始浓度分别为:c(H2)=4 mol·L-1,c(N2)=3 mol·L-1,c(NH3)=0.5 mol·L-1,经3 min后,c(NH3)=0.8 mol·L-1,该反应的反应速率是
A. v(H2)=0.7 mol·(L·min)–1 B. v(NH3)=0.3 mol·(L·min)-1
C. v(H2)=0.2 mol·(L·min)-1 D. v(H2)=0.15 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.6 g H2O的物质的量是____,含有水分子的数目是_____,含有氢原子的物质的量是_____。
(2)1.5molCO2和______g CH4在标准状况下占有相同的体积,其体积为________。
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量为________。
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为______mol;一个X原子的质量为_______g;该气体在标准状况下的体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com